Sommaire
La résorption radiculaire inflammatoire est un état pathologique qui peut être causé par plusieurs facteurs étiologiques, y compris un traumatisme dentaire. Cette étude de cas décrit le traitement d'une incisive latérale supérieure atteinte d'une importante résorption radiculaire inflammatoire perforante. Un garçon de 11 ans présentait une douleur, une mobilité et un trajet fistuleux associés à une incisive latérale supérieure dont la racine avait été obturée à la suite d'un traumatisme antérieur. L'examen radiographique a révélé la présence d'une large lésion périradiculaire avec résorption pathologique de la région apicale de la racine. L'obturation canalaire a été retirée, puis la dent a été traitée par l'application intracanalaire d'hydroxyde de calcium pendant 2 semaines. Le pansement à l'hydroxyde de calcium a ensuite été retiré et tout le canal radiculaire a été obturé avec un agrégat minéral de trioxyde. La cavité d'accès endodontique a été restaurée avec une résine composite. Un an plus tard, la guérison osseuse de la région périradiculaire était bien amorcée et le patient ne présentait plus aucun symptôme clinique.
Introduction
La résorption radiculaire inflammatoire (RRI) est un état pathologique qui provoque une perte progressive de la structure radiculaire1-4. Cet état est souvent dû à une périodontite apicale3,5 et à des traumatismes4,6-8, bien qu'une variété d'autres facteurs étiologiques – y compris des tumeurs et des kystes en expansion5 et des forces orthodontiques excessives9 – puissent aussi en être la cause. Dans certains cas, la RRI peut être associée à des facteurs idiopathiques10,11. Comme la RRI est asymptomatique, elle peut prendre des dimensions importantes (c.-à-d. raccourcissement significatif de l'apex radiculaire et hypertrophie ou perforation du canal radiculaire) avant qu'elle ne soit détectée 1-3,5,9. Un traitement endodontique devrait donc être institué rapidement pour éviter que la perte de tissus durs et la perforation radiculaire ne s'aggravent, sauf si la résorption résulte d'un traitement orthodontique12. Dans les cas avancés, il peut s'avérer nécessaire de réparer le site de la perforation avec un biomatériau approprié avant d'entreprendre le traitement endodontique13.
L'agrégat minéral de trioxyde (mineral trioxide aggregate, MTA) a été proposé comme matériau de réparation, car il crée une bonne étanchéité et procure une excellente adaptation marginale14. Des études cliniques ont confirmé la biocompatibilité de ce matériau et ont démontré son effet d'induction sur les tissus durs15,16. En plus de son activité antimicrobienne17, le MTA peut créer un milieu favorable à la guérison péridentaire et permettre le développement de nouveau cément à sa surface18. Le MTA se compose de fines particules hydrophiles et peut durcir en présence d'humidité et de sang19; de plus, son application requiert au plus 2 séances20. Ces propriétés favorables en font un matériau indiqué pour la restauration des perforations radiculaires21,22.
Dans l'étude de cas qui suit, nous décrivons les particularités cliniques et radiologiques d'une incisive supérieure, qui avait subi une obturation canalaire à la suite d'un traumatisme préalable et qui présentait une importante résorption radiculaire inflammatoire perforante; nous présentons aussi les résultats observés 12 mois après un traitement par le MTA.
Étude de cas
Un garçon de 11 ans en bonne santé a été dirigé vers la clinique en raison principalement d'une douleur et d'une tuméfaction au tiers gingival de la face buccale de l'incisive latérale supérieure droite. Selon les rapports, la dent avait subi un traumatisme durant une chute accidentelle lorsque le garçon avait 9 ans et demi; un traitement d'urgence associant un jumelage et une antibiothérapie avait alors été dispensé par un dentiste de la région. Deux mois plus tard, le dentiste a entrepris un traitement endodontique de l'incisive, car le patient ressentait toujours de la douleur. Un an après l'obturation canalaire, le dentiste a recommandé que le patient soit traité dans une clinique universitaire, car la douleur et la tuméfaction persistaient.
L'examen intrabuccal a révélé une décoloration de la couronne de l'incisive latérale supérieure droite, associée à un trajet fistuleux du côté buccal. La dent était légèrement mobile et sensible à la percussion. L'examen radiographique de l'incisive latérale montrait une résorption inégale étendue de la région apicale de la racine, ainsi qu'une large radioclarté périradiculaire (ill. 1a). L'obturation canalaire était très courte et la portion apicale de la racine pénétrait dans la cavité créée par la résorption. En suivant la lamina dura à partir de la face mésiale de la racine, une structure apicale conique fortement évocatrice de l'apex radiculaire a été observée. Comme les radiographies prises au moment du diagnostic de périodontite apicale n'étaient pas disponibles, on a présumé que le premier dentiste avait préféré obturer le canal radiculaire sous le niveau de la résorption ou, dans l'éventualité d'une large ouverture apicale, sous le niveau de la convergence apicale.
Sur la base de ces observations cliniques et radiologiques un nouveau plan de traitement endodontique a été proposé aux parents et au patient; ce plan prévoyait l'application intracanalaire de MTA pour traiter la résorption radiculaire inflammatoire. Le plan a été approuvé et il a été institué durant la même visite. Après l'administration d'un anesthésique et la mise en place d'une digue, la gutta-percha et le scellant ont été délicatement retirés du canal radiculaire à l'aide de limes Hedströem (Dentsply-Maillefer, Ballaigues, Suisse) et le canal a été abondamment irrigué avec de l'hypochlorite de sodium à 1,25 % (NaOCl). Durant l'instrumentation, on a pris soin de ne pas élargir le canal radiculaire. Une radiographie rétroalvéolaire a révélé l'étendue d'une large résorption semi-lunaire perforante qui touchait le tiers apical de la racine (ill. 1b). Après avoir retiré le matériau d'obturation canalaire, une dernière irrigation avec du NaOCl à 1,25 % et du sérum physiologique stérile a été réalisée, puis le canal radiculaire a été asséché avec des pointes de papier stériles. De l'hydroxyde de calcium a été mis en place dans le canal et un scellement coronaire temporaire a été créé avec du Cavit (3M ESPE, Seefeld, Allemagne).
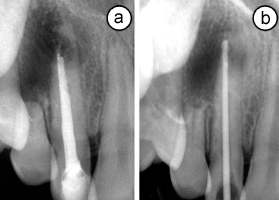 Ill. 1 : (a) Vue radiologique de l'incisive latérale supérieure montrant une résorption radiculaire pathologique et une lésion périradiculaire. (b) Vue de la racine après le retrait de l'obturation canalaire. Un cône de gutta-percha montre l'étendue de la résorption radiculaire inflammatoire perforante.
Ill. 1 : (a) Vue radiologique de l'incisive latérale supérieure montrant une résorption radiculaire pathologique et une lésion périradiculaire. (b) Vue de la racine après le retrait de l'obturation canalaire. Un cône de gutta-percha montre l'étendue de la résorption radiculaire inflammatoire perforante.
Deux semaines plus tard, le trajet fistuleux et les symptômes avaient disparu. L'hydroxyde de calcium a été retiré délicatement en irriguant abondamment avec du NaOCl à 1,25 % et du sérum physiologique stérile, et le canal a été asséché avec des pointes de papier. Le MTA (White Pro-Root MTA; Dentsply-Maillefer) a été préparé selon les instructions du fabricant, et une petite quantité a été déposée à 1 mm sous la face coronaire du site de résorption au moyen d'une seringue à piston ProRoot MTA (Dentsply-Maillefer). Le MTA a ensuite été délicatement tassé sur toute la longueur de travail du canal en utilisant un fouloir endodontique. Cette procédure a été répétée plusieurs fois jusqu'à ce que le canal radiculaire soit rempli de MTA jusqu'à environ 1 mm apicalement au niveau gingival (ill. 2a). Une boulette de coton humide a été placée sur le MTA et la cavité a été scellée temporairement avec un ciment de verre ionomère. Après un délai d'attente d'une semaine sans complication, la cavité d'accès a été rouverte, restaurée avec une résine composite hybride (TPH Spectrum Dentsply/DeTrey, Constance, Allemagne) et collée avec un adhésif de type mordançage et rinçage (Prime & Bond NT, Dentsply/DeTrey).
Au moment du suivi après 6 mois, la radiographie montrait un début de guérison osseuse dans la lésion périradiculaire et l'absence de symptômes cliniques et de mobilité (ill. 2b). Un an plus tard, la lésion était presque complètement guérie, montrant une régénération avancée des tissus périradiculaires sans élargissement du site de résorption (ill. 2c).
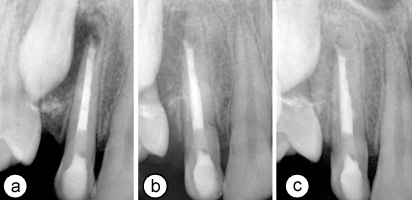 Ill. 2 : (a) Radiographie rétroalvéolaire montrant le canal radiculaire obturé avec de l'agrégat minéral de trioxyde. (b) Vue radiologique de la dent après 6 mois et (c) 1 an. À noter l'étendue de la guérison périradiculaire et la stabilité du site de résorption.
Ill. 2 : (a) Radiographie rétroalvéolaire montrant le canal radiculaire obturé avec de l'agrégat minéral de trioxyde. (b) Vue radiologique de la dent après 6 mois et (c) 1 an. À noter l'étendue de la guérison périradiculaire et la stabilité du site de résorption.
Discussion
En raison du caractère asymptomatique de la RRI et de ses diverses manifestations morphologiques, il est difficile d'établir un diagnostic précis de la plupart des cas de RRI à partir des radiographies bidimensionnelles3,23. Le diagnostic à partir de radiographies peut être encore plus difficile lorsque, comme ce fut le cas ici, il y a présence d'une obturation canalaire qui peut se superposer à la lésion de résorption. Bien que le diagnostic de RRI soit beaucoup plus facile par tomodensitométrie (TDM) à faisceau conique que par radiographie rétroalvéolaire23, notre centre n'avait pas accès à cette technologie au moment de l'admission du patient.
Lorsque la résorption initiale pénètre le cément et expose les tubules dentinaires, les toxines libérées par les bactéries présentes dans les tubules peuvent se propager au ligament parodontal4, de sorte que le processus ostéoclastique et l'inflammation du ligament parodontal qui y est associée se poursuivent, ce qui mène à la résorption de la lamina dura et de l'os adjacent1-4. Le protocole de traitement de la RRI devrait donc inclure l'élimination des bactéries du système radiculaire1-4 et il est très probable que ce traitement réussisse si un protocole de désinfection exhaustif est utilisé24,25. Le NaOCl est toutefois toxique en fortes concentrations et il y a un risque à l'utiliser pour le rinçage de dents avec perforations. Aussi est-il recommandé d'utiliser du NaOCl moins concentré pour réduire le risque de toxicité26. Dans le cas présent, le NaOCl à 1,25 % n'a pas eu d'effets indésirables sur les tissus, même s'il a été impossible d'éviter que ce produit pénètre au-delà du site de perforation. Après le débridement du canal radiculaire et l'irrigation par le NaOCl, il est courant d'appliquer de l'hydroxyde de calcium à l'intérieur du canal durant une courte période pour désinfecter le système canalaire27. Cette procédure a pour effet de supprimer les stimulus qui causent l'inflammation périradiculaire et d'arrêter le processus de résorption et, idéalement, elle permet aussi le rétablissement de l'espace parodontal28. Cependant, comme ce fut le cas ici, il arrive que des tissus osseux envahissent la cavité de résorption lorsqu'il y a atteinte d'une large section de la racine1,3,4.
Dans notre cas, divers facteurs justifiaient l'obturation du canal entier par le MTA. D'abord, il fallait mettre en place un bouchon apical de MTA d'au moins 4 mm d'épaisseur pour procurer un scellement apical optimal29. Ensuite, une barrière cervicale d'environ 4 mm d'épaisseur était nécessaire pour prévenir l'infiltration coronaire30. Comme la longueur combinée de ces bouchons apical et coronaire correspondait à peu près à la longueur du canal radiculaire restant, on a considéré que l'obturation de la totalité du canal avec du MTA, plutôt qu'une obturation rétrograde avec de la gutta-percha, serait la technique la plus rapide et la plus efficace. Enfin, en l'absence de TDM à faisceau conique, on ne pouvait écarter la possibilité que la résorption soit plus étendue et plus complexe que ce que la radiographie semblait indiquer, d'où la décision de tenter de sceller le canal radiculaire avec un matériau biocompatible. Il a été démontré que l'application intracanalaire de MTA peut aussi causer la libération d'ions calcium par les tubules dentinaires dans les sites de résorption externe et favoriser ainsi le potentiel de réparation des tissus adjacents31.
La biocompatibilité du MTA et son effet inducteur sur les tissus durs ont été confirmés, non seulement par de nombreuses études en laboratoire, mais aussi par des études chez les humains, en particulier lorsque le MTA est utilisé pour créer une barrière à l'extrémité de la racine dans les dents à apex immature15,16 et les cas de perforations radiculaires18. Dans le cas présenté ici, les observations radiographiques après 6 et 12 mois ont révélé que la légère extrusion du MTA au-delà du canal radiculaire n'avait pas eu d'effet sur la guérison du site de résorption. Ces résultats corroborent ceux d'études précédentes sur des animaux32 et des humains16 qui ont révélé que le contact entre le MTA extrudé et les tissus périapicaux ne provoque pas de réponse chez l'hôte et n'est donc pas un obstacle à la guérison.
Bien qu'il n'y ait pas eu rétablissement de tout l'espace parodontal, le traitement dispensé dans le cas présent a été considéré comme un succès sur les plans clinique et radiologique. Il y a eu guérison complète de la radiotransparence dans l'os alvéolaire et régénération continue des tissus osseux, et le site de résorption est demeuré stable durant toute la période de suivi de 12 mois. Dans l'ensemble, le patient et ses parents ont été satisfaits de l'issue du traitement, car celui-ci a permis de préserver une dent permanente fonctionnelle.
LES AUTEURS
Références
- Andreasen JO, Andreasen FM. Essentials of traumatic injuries to the teeth. 2nd ed. Copenhagen: Munksgaard; 2001. p. 188.
- Trope M, Chivian N, Sigurdsson A, Vann WF. Traumatic injuries. In: Cohen S, Burns RC. Pathways of the pulp. 8th ed. St Louis: Mosby; 2002. p. 603-49.
- Nair PN. Apical periodontitis: a dynamic encounter between root canal infection and host response. Periodontology 2000. 1997;13(1):121-48.
- Andreasen JO, Andreasen FM, Bakland LK, Flores MT. Traumatic dental injuries — a manual. 1st ed. Copenhagen: Munksgaard; 2000. p. 10.
- Laux M, Abbott PV, Pajarola G, Nair PN. Apical inflammatory root resorption: a correlative radiographic and histological assessment. Int Endod J. 2000;33(6):483-93.
- Andreasen JO, Borum MK, Jacobsen HL, Andreasen FM. Replantation of 400 avulsed permanent incisors. 4. Factors related to periodontal ligament healing. Endod Dent Traumatol. 1995;11(2):76-89.
- Andreasen JO, Bakland LK, Matras RC, Andreasen FM. Traumatic intrusion of permanent teeth. Part 1. An epidemiological study of 216 intruded permanent teeth. Dent Traumatol. 2006;22(2):83-9.
- Hinckfuss SE, Messer LB. An evidence-based assessment of the clinical guidelines for replanted avulsed teeth. Part I: Timing of pulp extirpation. Dent Traumatol. 2009;25(1):32-42.
- Weltman B, Vig KW, Fields HW, Shanker S, Kaizar EE. Root resorption associated with orthodontic tooth movement: a systematic review. Am J Orthod Dentofacial Orthop. 2010;137(4):462-76.
- Gunraj MN. Dental root resorption. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 1999;88(6):647-53.
- Bakland LK. Root resorption. Dent Clin North Am. 1992;36(2):491-507.
- Altundasar E, Demir B. Management of a perforating internal resorptive defect with mineral trioxide aggregate: a case report. J Endod. 2009;35(10):1441-4.
- Heithersay GS. Clinical endodontic and surgical management of tooth and associated bone resorption. Int Endod J. 1985;18(2):72-92.
- Al-Kahtani A, Shostad S, Schifferle R, Bhambhani S. In-vitro evaluation of microleakage of an orthograde apical plug of mineral trioxide aggregate in permanent teeth with simulated immature apices. J Endod. 2005;31(2):117-9.
- Holden DT, Schwartz SA, Kirkpatrick TC, Schindler WG. Clinical outcomes of artificial root-end barriers with mineral trioxide aggregate in teeth with immature apices. J Endod. 2008;34(7):812-7.
- Mente J, Hage N, Pfefferle T, Koch MJ, Dreyhaupt J, Staehle HJ, et al. Mineral trioxide aggregate apical plugs in teeth with open apical foramina: a retrospective analysis of treatment outcome. J Endod. 2009;35(10):1354-8.
- Zhang H, Pappen FG, Haapasalo M. Dentin enhances the antibacterial effect of mineral trioxide aggregate and bioaggregate. J Endod. 2009;35(2):221-4. Epub 2008 Dec 12.
- Torabinejad M, Parirokh M. Mineral trioxide aggregate: a comprehensive literature review--part II: leakage and biocompatibility investigations. J Endod. 2010;36(2):190-202.
- Vanderweele RA, Schwartz SA, Beeson TJ. Effect of blood contamination on retention characteristics of MTA when mixed with different liquids. J Endod. 2006;32(5):421-4.
- Witherspoon DE, Small JC, Regan JD, Nunn M. Retrospective analysis of open apex teeth obturated with mineral trioxide aggregate. J Endod. 2008;34(10):1171-6. Epub 2008 Aug 13.
- Torabinejad M, Chivian N. Clinical applications of mineral trioxide aggregate. J Endod. 1999;25(3):197-205.
- Holland R, Filho JA, de Souza V, Nery MJ, Bernabé PF, Junior ED. Mineral trioxide aggregate repair of lateral root perforations. J Endod. 2001;27(4):281-4.
- Estrela C, Bueno MR, De Alencar AH, Mattar R, Valladares Neto J, Azevedo BC, et al. Method to evaluate inflammatory root resorption by using cone beam computed tomography. J Endod. 2009;35(11):1491-7.
- Byström A, Happonen RP, Sjögren U, Sundqvist G. Healing of periapical lesions of pulpless teeth after endodontic treatment with controlled asepsis. Endod Dent Traumatol. 1987;3(2):58-63.
- Sjögren U, Figdor D, Persson S, Sundqvist G. Influence of infection at the time of root filling on the outcome of endodontic treatment of teeth with apical periodontitis. Int Endod J. 1997;30(5):297-306.
- Hülsmann M, Hahn W. Complications during root canal irrigation--literature review and case reports. Int Endod J. 2000;33(3):186-93.
- Sjögren U, Figdor D, Spångberg L, Sundqvist G. The antimicrobial effect of calcium hydroxide as a short-term intracanal dressing. Int Endod J. 1991;24(3):119-25.
- Hammarstrom L, Lindskog S. General morphological aspects of resorption of teeth and alveolar bone. Int Endod J. 1985;18(2):93-108.
- Valois CR, Costa ED Jr. Influence of the thickness of mineral trioxide aggregate on sealing ability of root-end fillings in vitro. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2004;97(1):108-11.
- Barrieshi-Nusair KM, Hammad HM. Intracoronal sealing comparison of mineral trioxide aggregate and glass ionomer. Quintessence Int. 2005;36(7-8):539-45.
- Ozdemir HO, Ozçelik B, Karabucak B, Cehreli ZC. Calcium ion diffusion from mineral trioxide aggregate through simulated root resorption defects. Dent Traumatol. 2008;24(1):70-3.
- Shabahang S, Torabinejad M, Boyne PP, Abedi H, McMillan P. A comparative study of root-end induction using osteogenic protein-1, calcium hydroxide, and mineral trioxide aggregate in dogs. J Endod. 1999;25(1):1-5.
