Voir le courrier touchant cet article.
Sommaire
Un abcès dentaire sur une molaire primaire aurait été la cause d'un abcès cérébral chez un garçon de 11 ans. Cette étude de cas décrit les signes et symptômes neurologiques ainsi que la prise en charge urgente d'un abcès cérébral chez un enfant. L'établissement d'un diagnostic provisoire d'abcès cérébral repose sur les antécédents médicaux du patient et sur les signes et symptômes présents (fièvre, maux de tête, nausées, vomissements, déficit neurologique focal, altération de l'état de conscience et de l'élocution, œdème papillaire et raideur de la nuque ou crises épileptiques). Le diagnostic formel est confirmé par imagerie. L'origine dentaire de l'infection est établie par exclusion d'autres foyers plus probables comme les oreilles, le cœur, les poumons, les yeux ou les sinus.
Introduction
Des abcès dentaires ou une cellulite faciale amènent les dentistes à soupçonner la présence possible d'autres affections susceptibles de menacer le pronostic vital, comme une septicémie ou l'obstruction des voies respiratoires. Les dentistes envisagent toutefois rarement l'abcès cérébral comme une complication possible d'une infection odontogène. Cette étude décrit le cas d'un garçon de 11 ans chez qui l'abcès cérébral et les signes neurologiques connexes ont fort probablement été causés par un abcès sur une molaire primaire (ill. 1a et 1b). La description des signes et des symptômes neurologiques, ainsi que de l'histoire et de la prise en charge de ce cas, renseignera les dentistes sur le risque réel d'abcès cérébral d'origine dentaire.
 Ill. 1a : Carie profonde sur la deuxième molaire primaire inférieure gauche chez un garçon de 11 ans.
Ill. 1a : Carie profonde sur la deuxième molaire primaire inférieure gauche chez un garçon de 11 ans.
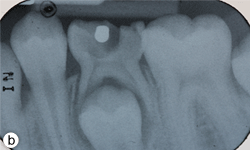 Ill. 1b : Radiographie rétroalvéolaire montrant une carie profonde et une zone radioclaire à la furcation sur la dent 75.
Ill. 1b : Radiographie rétroalvéolaire montrant une carie profonde et une zone radioclaire à la furcation sur la dent 75.
Les abcès cérébraux sont des affections rares, mais graves, qui menacent le pronostic vital et qui s'accompagnent d'une morbidité et d'une mortalité élevées1-6. Un abcès cérébral est une infection focale dans le parenchyme cérébral, qui se caractérise par un œdème localisé et une inflammation causant une accumulation bien circonscrite de pus7. Les abcès cérébraux peuvent être causés par l'extension directe d'un foyer purulent contigu, la dissémination hématogène de l'infection à partir d'un foyer à distance ou l'inoculation directe durant un traumatisme ou une neurochirurgie1,8. Dans 15 à 30 % des cas toutefois, l'étiologie des abcès cérébraux est inconnue9. La majorité des abcès cérébraux résultent de la propagation directe de l'infection à travers les plans faciaux et ces abcès prennent souvent naissance dans les sinus paranasaux, l'oreille moyenne ou la région mastoïdienne1,10. Les abcès cérébraux sont rares chez les enfants mais sont plus susceptibles de se produire durant la première décennie de vie en raison de la prévalence plus élevée d'infections des sinus et de l'oreille moyenne dans ce groupe d'âge1,3,7,11. Les cardiopathies congénitales, les infections des sinus, les infections des oreilles et l'immunodépression sont les facteurs de prédisposition les plus fréquents chez les enfants atteints d'abcès cérébral1,3,7,11. L'infection à diffusion hématogène se propage par la circulation générale ou par le sang qui circule dans les veines faciales et ophtalmiques où les pathogènes pénètrent dans le crâne par le sinus caverneux10,12-14. Selon Zhang et Stringer10, qui ont disséqué de nombreuses valvules dans les veines faciales et ophtalmiques que l'on croyait jusque-là sans valvules, le risque plus élevé de diffusion hématogène de l'infection dans la région médiofaciale serait attribuable à une communication continue entre la veine faciale, le plexus ptérygoïdien, les veines angulaire et ophtalmique et le sinus caverneux, et non au flux rétrograde dans des veines sans valvules. Les sources primaires les plus répandues d'abcès cérébraux sont l'endocardite infectieuse, l'ostéomyélite, la bactériémie et les infections pulmonaires, abdominales, pelviennes, cutanées ou dentaires9.
La fièvre, les maux de tête, les nausées, les vomissements, le déficit neurologique focal, l'altération de l'état de conscience et de l'élocution, la léthargie, l'œdème papillaire, la raideur de la nuque et l'élévation de la pression intracrânienne ou les crises épileptiques sont des manifestations cliniques courantes d'un abcès cérébral3,15,16. Les signes et les symptômes du déficit neurologique varient en fonction de la région du cerveau qui est atteinte.
Comme les abcès cérébraux sont rares, que les sources primaires possibles d'infection sont nombreuses et que les bactéries dans la cavité buccale sont variées, le diagnostic d'abcès cérébral par suite d'une infection dentaire se fait par exclusion. Parmi les critères utilisés pour attribuer un abcès cérébral à une source dentaire d'infection, mentionnons l'absence d'autres sources d'infection, la présence de la microflore buccale dans le spectre microbiologique de l'abcès cérébral et la manifestation des signes cliniques et radiologiques d'une infection dentaire aigüe ou chronique17.
Les dentistes devraient savoir que même une dent dévitalisée inactive peut causer une septicémie bactérienne à diffusion hématogène. La présence de signes et de symptômes neurologiques aberrants pourrait indiquer les premiers stades d'un abcès cérébral. Le diagnostic d'abcès cérébral par un médecin est suivi de la recherche de la source primaire d'infection. L'identification d'un foyer d'infection d'origine dentaire est essentielle au diagnostic et au traitement.
Étude de cas
Un garçon de 11 ans jusque-là en bonne santé a été amené au service d'urgence d'un hôpital communautaire pour des maux de tête sourds et continus qui persistaient depuis 2 semaines et des nausées et vomissements présents depuis 1 semaine. Un diagnostic différentiel de grippe ou de migraines a été posé et le garçon a obtenu son congé; on lui a recommandé le repos au lit et un traitement de soutien.
Le lendemain, le patient a été transporté d'urgence au service d'urgence de l'Hôpital de Timmins et du district, après que sa mère l'a trouvé couché sur le sol, criant, se tenant la tête et marmonnant, incapable de prononcer des mots (dysphasie). Une confusion, une léthargie, une démarche instable et une raideur de la nuque d'apparition brutale ont aussi été observées. Des examens d'imagerie par résonance magnétique (ill. 2a et 2b) ont révélé la présence d'une lésion à paroi mince de 4,7 x 4,4 x 3,4 cm entourée d'un œdème dans le lobe temporal gauche. Une polychimiothérapie (dexaméthasone, mannitol, vancomycine et ceftriaxone) a été instaurée et le patient a immédiatement été transporté par voie aérienne au Hospital for Sick Children (SickKids) de Toronto.
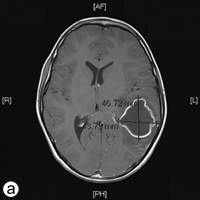
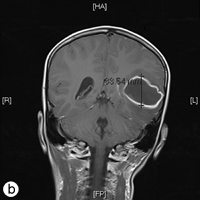
Ill. 2 : Vues a) axiale et b) frontale de l'imagerie par résonance magnétique montrant un abcès de 4,7 x 4,4 x 3,5 cm dans le lobe temporal gauche du cerveau.
À son arrivée au service d'urgence du SickKids (jour 1), le patient était éveillé et bien orienté dans le temps et l'espace, et l'amplitude des mouvements des membres était complète. L'enfant présentait toutefois une importante dysphasie. Ses antécédents médicaux ne faisaient mention d'aucune sinusite, otite moyenne ou infection des voies respiratoires supérieures récente, mais indiquaient que le garçon avait eu un mal de dent quelque 3 semaines auparavant qui s'était dissipé depuis. La mère du patient a indiqué que l'enfant avait présenté une tuméfaction localisée au niveau de la dent quelque 2 semaines auparavant; la douleur avait disparu après la rupture de la tuméfaction. Le patient a été admis en neurochirurgie (jour 2) et a subi sans complication une craniotomie avec ponction sous échoguidage d'un abcès cérébral temporo-pariétal du côté gauche. Une mise en culture et un antibiogramme ont été faits et une antibiothérapie intraveineuse à large spectre associant vancomycine, ceftriaxone et métronidazole a été maintenue. Le lendemain, le patient a dit ressentir de «drôles de sensations», et un affaissement hémifacial fortement évocateur d'une crise épileptique partielle a été observé du côté droit. De la phénytoïne a donc été prescrite. La tomodensitométrie a révélé une diminution de la taille de l'abcès, un effet de masse persistant avec déplacement de la ligne médiane vers la droite et un œdème cérébral diffus.
À l'examen dentaire, une carie profonde de la deuxième molaire primaire inférieure gauche (dent 75) a été observée. Aucune tuméfaction, aucune purulence ni aucun autre signe d'infection n'ont été notés. Les radiographies intrabuccales montraient une zone radioclaire à la furcation associée à la dent 75 (ill. 1a et 1b). Un diagnostic d'abcès dentaire a été posé en fonction des signes cliniques et des observations radiologiques. La dent 75 a ensuite été extraite sous anesthésie générale (jour 5) et des échantillons ont été prélevés pour mise en culture et antibiogramme.
Une semaine plus tard (jour 14), l'imagerie de suivi a montré une récurrence de l'abcès temporo-pariétal à gauche. Une deuxième craniotomie a été pratiquée et l'aspirat a été recueilli aux fins d'analyses microbiologiques.
Les analyses microbiologiques ont donné les résultats suivants. Streptococcus anginosus a été isolé des cultures obtenues durant la première craniotomie (jour 2). La mise en culture des échantillons prélevés au site de l'extraction dentaire a révélé la prolifération de nombreuses espèces de Streptococcus en conditions aérobies et la prolifération de la flore habituelle avec quelques neutrophiles en conditions anaérobies. La culture obtenue à la deuxième craniotomie contenait de nombreux neutrophiles, mais aucune microflore.
Une amélioration importante de l'état neurologique a été observée après la deuxième craniotomie. Des tomodensitométries hebdomadaires ont été réalisées durant les visites de suivi. Les images ont montré une diminution progressive de la taille de l'abcès. Dans l'ensemble, les fonctions neurologiques se sont améliorées, mais le patient avait toujours des difficultés de compréhension.
Cinq semaines après son admission, le patient a été transféré à l'hôpital de réadaptation pédiatrique Holland Bloorview Kids Rehabilitation Hospital pour y suivre un traitement intensif de réadaptation. Le patient est retourné à la maison 93 jours après son admission au SickKids. Il continue un programme de réadaptation en externe sous les soins d'orthophonistes et d'ergothérapeutes du Holland Bloorview Kids Rehabilitation Hospital. Du lévétiracétam lui a été prescrit et un suivi à 6 mois a été prévu au service de neurochirurgie du SickKids.
Discussion
Des infections dentaires ont été mises en cause dans de multiples cas d'abcès cérébraux et dans la mort récente d'un enfant à Boston8,18,19. Parmi les sources dentaires connues d'abcès cérébraux, mentionnons l'abcès dentaire, la cellulite, la parodontite, les extractions, les traitements de canal, la mise en place d'appareils orthodontiques et l'ostéomyéite8,18,20. Les cultures faites à partir des échantillons prélevés d'abcès cérébraux contiennent souvent des microorganismes qui abondent dans la muqueuse buccale et la plaque dentaire, comme des bactéries Gram positif (p. ex. Streptococcus et Staphylococcus), des bactéries Gram négatif (p. ex. Haemophilus) et des champignons, ce qui laisse croire que la cavité buccale constitue une source primaire probable d'infection1,3,21,22.
L'abcès cérébral observé dans le cas présent a probablement été causé par une infection dentaire. Le diagnostic a été posé par élimination des autres sources d'infection, les critères suivants ayant servi à déterminer que l'abcès cérébral aurait été causé par une infection dentaire17 :
- Absence d'autres sources d'infection : Les antécédents médicaux du patient et les explorations cliniques ont permis d'exclure une sinusite, une otite moyenne ou une infection des voies respiratoires supérieures récente comme possibles facteurs contribuants. L'échocardiogramme n'a montré aucun signe de shunts ou de végétations intracardiaques et a confirmé le flux laminaire dans la veine cave inférieure, la veine cave supérieure et l'aorte abdominale. Les radiographies des poumons et de l'abdomen n'ont indiqué aucun résultat significatif.
- Présence de la microflore buccale dans le spectre microbiologique : Streptococcus anginosus a été isolé de l'échantillon prélevé durant la première craniotomie. S. anginosus est souvent présent dans la salive, la plaque dentaire, les infections dentaires ainsi que le tube digestif et l'appareil génito-urinaire23. S. anginosus est fortement associé à des infections purulentes, des bactériémies et des abcès cérébraux en raison de sa grande résistance à la phagocytose par les leucocytes polynucléaires humains21,24. S. anginosus présent dans la cavité buccale s'est probablement introduit dans le système vasculaire pour ensuite se propager au parenchyme cérébral.
- Présence des signes et des symptômes cliniques et radiologiques d'une infection dentaire aigüe ou chronique : Les antécédents dentaires de ce patient, ainsi que les examens cliniques et radiographiques, ont révélé la présence d'un abcès dentaire sur la deuxième molaire primaire inférieure gauche (dent 75). Sur le plan clinique, la radiographie montrait des signes de carie et une zone radioclaire à la furcation associée à la dent 75.
La récurrence d'un abcès cérébral n'est pas rare (6 à 87 %), le taux de récurrence variant en fonction du siège et de la taille de l'abcès et du traitement choisi25. Dans la majorité des cas, la récurrence survient dans les 2 semaines suivant le début du traitement25. Dans le cas présent, la récurrence de l'abcès cérébral s'est produite 2 semaines après l'admission du patient au SickKids. La récurrence a été basée principalement sur l'abcès cérébral, et les analyses microbiologiques négatives ont été attribuées à l'usage prolongé d'antibiotiques à large spectre d'action.
En résumé, il semble que la deuxième molaire primaire inférieure gauche ait été la cause d'un abcès cérébral qui a nécessité un transport d'urgence par hélicoptère de Timmins à Toronto, deux chirurgies du cerveau, une extraction dentaire sous anesthésie générale et une longue période continue de réadaptation. Mais plus important encore, l'intervention a permis de sauver la vie de ce garçon de 11 ans, qui était atteint d'une infection comportant un haut taux de mortalité et de morbidité. Il convient de rappeler aux dentistes que des symptômes neurologiques évolutifs peuvent indiquer un abcès cérébral et que les patients qui présentent ces symptômes devraient rapidement être dirigés vers un service d'urgence pour évaluation et prise en charge de toutes sources possibles d'infection dentaire.
Conclusion
Les abcès cérébraux peuvent être causés par des infections dentaires et le traitement des infections odontogènes peut éviter l'apparition d'un état susceptible de menacer le pronostic vital. Malgré la faible incidence des abcès cérébraux, une source dentaire d'infection devrait être envisagée dans le diagnostic différentiel de l'étiologie des abcès cérébraux.
LES AUTEURES
Références
- Sheehan JP, Jane JA Jr, Ray DK, Goodkin HP. Brain abscess in children. Neurosurg Focus. 2008;24(6):E6.
- Muzumdar D, Jhawar S, Goel A. Brain abscess: an overview. Int J Surg. 2011;9(2):136-44. Epub 2010 Nov 16.
- Carpenter J, Stapleton S, Holliman R. Retrospective analysis of 49 cases of brain abscess and review of the literature. Eur J Clin Microbiol Infect Dis. 2007;26(1):1-11.
- Tattevin P, Bruneel F, Clair B, Lellouche F, de Broucker T, Chevret S, et al. Bacterial brain abscesses: a retrospective study of 94 patients admitted to an intensive care unit (1980 to 1999). Am J Med. 2003;115(2):143-6.
- Yang SY. Brain abscess: a review of 400 cases. J Neurosurg. 1981;55(5):794-9.
- Alderson D, Strong AJ, Ingham HR, Selkon JB. Fifteen-year review of the mortality of brain abscess.Neurosurgery. 1981:8(1):1-6.
- Goodkin HP, Harper MB, Pomeroy SL. Intracerebral abscess in children: historical trends at Children's Hospital Boston. Pediatrics. 2004;113(6):1765-70.
- Azenha MR, Homsi G, Garcia IR Jr. Multiple brain abscess from dental origin: case report and literature review. Oral Maxillofac Surg. 2011;[Epub ahead print] DOI 10.1007/s10006-011-0308-3.
- Frazier JL, Ahn ES, Jallo GI. Management of brain abscesses in children. Neurosurg Focus. 2008;24(6):E8.
- Zhang J, Stringer MD. Ophthalmic and facial veins are not valveless. Clin Experiment Ophthalmol. 2010;38(5):502-10. Epub 2010 May 10.
- Fischer EG, McLennan JE, Suzuki Y. Cerebral abscess in children. Am J Dis Child. 1981;135(8):746-9.
- Baker SB, Weinzweig J, Bartlett SP, Whitaker LA. Brain abscess as a complication of orthognathic surgery: diagnosis, management and pathophysiology. Plast Reconstr Surg. 1999;104(2):480-2.
- Nishihara J, Takeuchi Y, Miki T, Itoh M, Nagahata S. Anatomical study on valves of human facial veins. J Craniomaxillofac Surg. 1995;23(3):182-6.
- Erickson SJ, Hendrix LE, Massaro BM, Harris GJ, Lewandowski MF, Foley WD, et al. Color Doppler flow imaging of the normal and abnormal orbit. Radiology. 1989;173(2):511-6.
- Gelabert-Gonzalez M, Serramito-Garcia R, Garcia-Allut A, Cutrin-Prieto J. Management of brain abscess in children. J Paediatr Child Health 2008;44(12):731-5. Epub 2008 Nov 18.
- Tseng JH, Tseng MY. Brain abscess in 142 patients: factors influencing outcome and mortality. Surg Neurol. 2006;65(6):557-62.
- Ewald C, Kuhn S, Kalff R. Pyogenic infections of the central nervous system secondary to dental affections – a report of six cases. Neurosurg Rev 2006; 29:163-6, discussion 166-7. Epub 2006 Feb 24.
- Corson MA, Postlethwaite KP, Seymour RA. Are dental infections a cause of brain abscess? Case report and review of the literature. Oral Dis. 2001;7(1):61-5.
- Otto M. For want of a dentist: Pr. George's boy dies after bacteria from tooth spread to brain. The Washington Post 2007 Feb 28. Disponible à : http://www.washingtonpost.com/wp-dyn/content/article/2007/02/27/AR2007022702116_pf.html. (consulté le 23 avril 2012)
- Wolf J, Curtis N. Brain abscess secondary to dental braces. Pediatr Infect Dis J. 2008;27(1):84-5.
- Morita E, Narikiyo M, Nishimura E, Yano A, Tanabe C, Sasaki H, et al. Molecular analysis of age-related changes of Streptococcus anginosus and Streptococcus mitis in saliva. Oral Microbiol Immunol. 2004;19:386-389.
- Al Masalma M, Lonjon M, Richet H, Dufour H, Roche PH, Drancourt M, et al. Metagenomic analysis of brain abscesses identifies specific bacterial associations. Clin Infect Dis. 2012;54(2):202-10. Epub 2011 Dec 5.
- Petti CA, Simmons KE, Bender J, Blaschke A, Webster KA, Conneely MF, et al. Culture-negative intracerebral abscesses in children and adolescents from Streptococcus anginosus group infection: a case series. Clin Infect Dis. 2008;46(10):1578-80.
- Okayama H, Nagata E, Ito H, Oho T, Inoue M. Experimental abscess formation caused by human dental plaque. Microbiol Immunol. 2005;49(5):399-405.
- Madhugiri VS, Sastri BV, Srikantha U, Banerjee AD, Somanna S, Devi BI, Chandramouli BA, et al. Focal intradural brain infections in children: an analysis of management and outcome. Pediatr Neurosurg. 2011;47(2):113-24. Epub 2011 Sep 2.
