Depuis 8 jours, un jeune homme de 16 ans avait de la fièvre (38,9 °C) et un mal de gorge réfractaires aux antibiotiques. Il était fébrile et anémique et présentait une adénopathie généralisée et une hépatomégalie. L'examen buccal a révélé la présence de lésions herpétiformes extrabuccales bilatérales douloureuses près du vermillon de la lèvre inférieure (ill. 1). Ces lésions ressemblaient à des grappes de vésicules incrustées. Des ulcérations intrabuccales, évocatrices d'une infection à herpès simplex, étaient présentes sur les gencives marginale et interdentaire des faces buccale et palatine de toutes les dents, ainsi que sur les bords latéraux de la langue (ill. 2 et 3). Ces ulcérations profondes taillées à l'emporte-pièce étaient recouvertes de plaques grumeleuses blanc laiteux, évocatrices d'une candidose buccale. La couleur des gencives variait d'un rouge pâle à violacé; de plus elles avaient perdu leur contour normal et avaient l'apparence de pelure d'orange; des taches et ecchymoses pourpres étaient aussi apparentes sur la face postéro-latérale du palais (ill.2) et une candidose était présente sur le tiers postérieur de la langue (ill.3). Enfin les gencives péricoronaires des deuxièmes molaires inférieures droite et gauche en éruption étaient enflammées et couvertes de candidose (ill.4). Le tartre et les taches étaient généralisés.
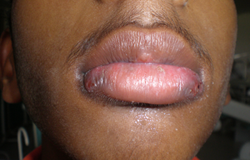 Ill. 1 : Lésions herpétiformes extrabuccales bilatérales avec vésicules et incrustation.
Ill. 1 : Lésions herpétiformes extrabuccales bilatérales avec vésicules et incrustation.
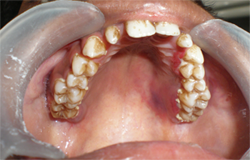 Ill. 2 : Ecchymoses palatines, gencives érythémateuses, friables et fortement tuméfiées et plaques interdentaires molles, grumeleuses et en saillie de couleur blanc laiteux, évocatrices d'une candidose.
Ill. 2 : Ecchymoses palatines, gencives érythémateuses, friables et fortement tuméfiées et plaques interdentaires molles, grumeleuses et en saillie de couleur blanc laiteux, évocatrices d'une candidose.
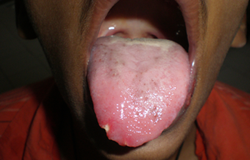 Ill. 3 : Ulcérations, candidose et ecchymoses (ecchymoses dues à une hémorragie) sur la langue.
Ill. 3 : Ulcérations, candidose et ecchymoses (ecchymoses dues à une hémorragie) sur la langue.
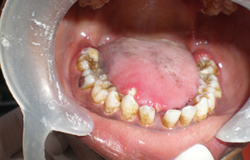 Ill. 4 : Ulcérations herpétiques et capuchons muqueux rouges, tuméfiés et œdémateux superposés à la candidose, apparents sur la langue et dans les espaces interdentaires.
Ill. 4 : Ulcérations herpétiques et capuchons muqueux rouges, tuméfiés et œdémateux superposés à la candidose, apparents sur la langue et dans les espaces interdentaires.
Quel est le diagnostic?
Diagnostic différentiel
Le diagnostic différentiel incluait les troubles suivants : immunodéficience, malignités hématologiques, infection virale, thérapie immunosuppressive, causes génétiques et affections systémiques (anémie aplastique, lupus érythémateux disséminé et neutropénie cyclique).
Immunodéficiences
La perturbation du fonctionnement du système immunitaire rend la personne plus sensible à de fréquentes infections graves et récurrentes des voies respiratoires, de la peau et des muqueuses. Ces infections sont classées en fonction du type de cellules atteintes, c.-à-d. anomalies des lymphocytes B, des lymphocytes T, des phagocytes ou de la cascade du complément. Les infections par de graves organismes Gram positif sont fréquentes dans les cas d'immunodéficiences dues à une anomalie des lymphocytes B, alors que les immunodéficiences touchant les lymphocytes T s'accompagnent de graves infections virales et fongiques.
Les immunodéficiences acquises sont le résultat de causes extrinsèques telles que la malnutrition, le vieillissement et certaines pharmacothérapies (p. ex., chimiothérapies anticancéreuses, stéroïdes et immunosuppresseurs administrés aux greffés et aux personnes atteintes de maladies auto-immunes). Les infections chroniques comme le syndrome d'immunodéficience acquise découlant du VIH altèrent elles aussi le fonctionnement du système immunitaire. Le VIH détruit les lymphocytes T-CD4 auxiliaires-inducteurs et altère l'immunité humorale et l'immunité à médiation cellulaire, rendant le patient très sensible aux infections opportunistes. Les manifestations associées à l'évolution générale d'une immunodéficience sont plus fréquentes chez les enfants à cause de l'immaturité de leur système immunitaire. Des antécédents de fièvre prolongée, de diarrhée chronique récurrente, de leucoplasie chevelue buccale et de sarcome de Kaposi peuvent être des facteurs différenciateurs. La numération des lymphocytes T-CD4+ devrait être déterminée si un enfant a un résultat positif au test virologique de dépistage du VIH.
Malignités hématologiques
Les déficits immunitaires de ce type peuvent être causés par une tumeur hématologique maligne sous-jacente ou une chimiothérapie. Les leucémies myéloïdes se caractérisent par une infiltration du sang, de la moelle osseuse et d'autres tissus par des cellules néoplasiques de la lignée granuleuse. Dans le cas de leucémies lymphoblastiques, la moelle osseuse est remplacée par de petits lymphoblastes immatures. Le diagnostic est basé sur l'aspiration et la cytologie de la moelle osseuse, l'immunophénotypage, l'immunohistochimie, l'analyse moléculaire et l'analyse cytogénétique. Le diagnostic du lymphome repose habituellement sur un examen microscopique d'une biopsie des ganglions lymphatiques, l'immunohistochimie et l'absence d'atteinte du sang périphérique.
Infection virale
La mononucléose infectieuse causée par le virus Epstein-Barr se caractérise par de la fièvre, une adénopathie, une hépatosplénomégalie et une altération des lymphocytes sanguins. On peut distinguer cet état de la leucémie aiguë à la morphologie particulière des lymphocytes et lymphoblastes réactifs et aux titres viraux élevés. De plus, les ganglions lymphatiques, le foie et la rate sont souvent mous et mal définis en présence d'une maladie virale, alors qu'ils sont fermes et discrets dans les cas de leucémie aiguë.
Thérapie immunosuppressive
Les immunosuppresseurs, qui incluent les glucocorticoïdes et les agents chimiothérapeutiques anticancéreux, affaiblissent le système de défense de l'hôte et rendent l'enfant plus sujet aux infections par des organismes opportunistes.
Causes génétiques
Le syndrome de Wiskott-Aldrich (WAS) est un déficit immunitaire héréditaire qui ne touche que les hommes et qui se caractérise par de graves infections opportunistes récurrentes, de l'eczéma et une thrombocytopénie. La diminution ou l'absence de la protéine WAS dans les cellules sanguines, ou la présence d'une mutation dans le gène qui code pour la protéine WAS, permet d'en confirmer le diagnostic. Les plaquettes WAS sont aussi beaucoup plus petites que les plaquettes normales.
Maladies systémiques
L'anémie aplastique est une rare dyscrasie sanguine, où la pancytopénie périphérique résulte d'une production réduite ou absente de cellules sanguines dans la moelle osseuse et où les tissus hématopoïétiques normaux de la moelle osseuse sont remplacés par une infiltration graisseuse de la moelle. La septicémie et l'hémorragie sont les principales causes de décès chez les personnes qui en sont atteintes, ces manifestations résultant respectivement d'une neutropénie et d'une thrombocytopénie. L'adénopathie, l'hépatosplénomégalie et les changements squelettiques associés à la leucémie sont absents dans ces maladies systémiques. L'aspiration ou la biopsie de la moelle osseuse permet d'en confirmer le diagnostic.
Le lupus érythémateux disséminé est une maladie auto-immune multi-systémique qui se caractérise par une vascularite étendue et la présence de divers autoanticorps. Au stade évolutif, cette maladie s'accompagne habituellement de fièvre, de douleurs articulaires, d'une anémie légère et d'ulcérations buccales. Les enfants atteints de lupus présentent souvent une adénopathie et une hépatosplénomégalie. Une polyarthrite symétrique non érosive, un érythème en papillon typique dans la zone malaire ainsi qu'un érythème discoïde avec des antécédents de photosensibilité de la figure et du thorax sont pathognomoniques. Les principaux résultats de laboratoire incluent une lymphopénie, une thrombocytopénie, de faibles taux du complément sérique, un titre élevé d'anticorps antinucléaires et un sédiment urinaire anormal.
La neutropénie cyclique, une autre maladie auto-immune, se caractérise par des fluctuations cycliques du taux de neutrophiles. Le cycle dure en moyenne 21 jours (14 à 36 jours) et est marqué par une grave neutropénie (numération des neutrophiles < 0,2 × 109/L) pendant 3 à 10 jours. En période de neutropénie, l'aspiration de la moelle osseuse montre des signes d'arrêt de la maturation au stade de myélocyte. La neutropénie cyclique est associée à de la fièvre, à des ulcérations buccales récurrentes, à une pharyngite, à une adénopathie cervicale et à des lésions cutanées. Les manifestations intrabuccales incluent une grave gingivite récurrente, la perte d'attache des tissus parodontaux, la formation de poches parodontales profondes ainsi qu'une importante perte d'os alvéolaire causant souvent la perte des dents.
Diagnostic du patient
Les antécédents et l'examen clinique du patient laissaient croire à une malignité hématologique – diagnostic qui a été corroboré par les résultats d'un frottis de sang périphérique. L'hémogramme a révélé un taux d'hémoglobine de 8,7 g/100 mL, une numération plaquettaire de 48 × 109/L, une numération leucocytaire élevée (210,5 × 109/L) et une élévation du nombre de myéloblastes (98 % du compte leucocytaire total) avec baisse concomitante du nombre de lymphocytes (2 % du compte leucocytaire). Le frottis de sang périphérique montrait une importante neutropénie (nombre absolu de neutrophiles [NAN], 0 × 109/L). La biopsie de la moelle osseuse et l'immunophénotypage ont confirmé le diagnostic de leucémie myéloblastique aiguë peu différenciée.
Une greffe précoce de moelle osseuse est le traitement de choix des leucémies myéloblastiques aiguës. Notre patient a suivi une chimiothérapie dans une clinique d'hématologie de la région et il est maintenant en phase de consolidation. Il attend de recevoir une allogreffe de moelle osseuse.
La leucémie s'accompagne d'une neutropénie fébrile qui se caractérise par de la fièvre (≥ 38,3 °C) et un faible nombre de neutrophiles. La neutropénie peut être bénigne (NAN 1,0-1,5 × 109/L), modérée (NAN 0,5-1,0 × 109/L) ou grave (NAN < 0,5 × 109/L). Une neutropénie grave augmente la sensibilité aux infections bactériennes ou fongiques et nuit à leur résolution. La leucémie altère également l'immunité à médiation cellulaire, ce qui peut accroître le risque d'infection par un virus latent intrinsèquement présent, comme le virus de l'herpès simplex (VHS) qui s'accompagne de manifestations sur les muqueuses buccales et péribuccales. Il est impératif de confirmer la gingivo-stomatite herpétique et la candidose par des analyses de laboratoire adéquates, même lorsqu'un traitement empirique préalable est envisagé.
Un traitement antifongique systémique est indiqué pour les patients qui sont à haut risque de septicémie à candida ou qui présentent une résistance relative aux agents antifongiques topiques. La nystatine sous forme de rince-bouche ou de suspension ou le clotrimazole en pastilles peuvent être recommandés pour le traitement de la candidose buccale. Si la candidose buccale s'accompagne d'un déficit immunitaire, le fluconazole ou la caspofungine sont indiqués. Il a été établi que l'usage prophylactique de l'antiviral acyclovir réduit l'incidence des infections buccales dues au VHS chez les patients atteints de leucémie myéloblastique aiguë. Les patients qui présentent une malignité hématologique sont à haut risque de septicémies dues à des bactéries odontogènes qui peuvent menacer le pronostic vital. Les extractions dentaires et autres chirurgies buccales devraient donc être pratiquées au moins 3 semaines avant le début de la chimiothérapie anticancéreuse. Un NAN supérieur à 1,0 × 109/L et une numération plaquettaire d'au moins 60 × 109/L sont acceptables pour pratiquer une chirurgie buccale.
Ce cas montre l'importance pour les dentistes de reconnaître les manifestations cutanéo-muqueuses de maladies systémiques. La cavité buccale est une importante voie d'entrée pour les microorganismes qui, chez des patients immunodéprimés, peuvent causer une atteinte systémique et des complications menaçant le pronostic vital. Si ces lésions ne sont pas détectées et traitées, elles provoquent souvent une infection foudroyante mortelle. La prophylaxie dentaire et le traitement de la carie et de la gingivite sont nécessaires pour éliminer les sources buccales d'infection.
LES AUTEURES
Références
- Whitlock JA, Gaynon PS. Acute lymphoblastic leukemia in children. In: Greer JP, Foerster J, Lukens JN, editors. Wintrobe’s clinical hematology. 11th ed. Lippincott: Lippincott Williams & Wilkins; 2003. p. 1752-74.
- Dupuis-Girod S, Medioni J, Haddad E, Quartier P, Cavazzana-Calvo M, Le Deist F, et al. Autoimmunity in Wiskott-Aldrich syndrome: risk factors, clinical features, and outcome in a single-center cohort of 55 patients. Pediatrics. 2003;111(5 Pt 1):e622-7.
- Sepúlveda E, Brethauer U, Rojas J, Le Fort P. Oral manifestations of aplastic anaemia in children. J Am Dent Assoc. 2006;137(4):474-8.
- Stichweh D, Pascual V. [Systemic lupus erythematosus in children]. An Pediatr (Barc). 2005;63(4):321-9. [Article in Spanish]. Erratum in: An Pediatr (Barc). 2005;63(5):468.
- Hughes WT, Armstrong D, Bodey GP, Bow EJ, Brown AE, Calandra T, et al. 2002 guidelines for the use of antimicrobial agents in neutropenic patients with cancer. Clin Infect Dis. 2002;34(6):730-51. Epub 2002 Feb 13.
