Sommaire
Le dentiste généraliste est habituellement le premier professionnel de la santé appelé à évaluer des maladies buccodentaires, à instaurer un traitement et à prendre en charge les complications. Bien que rares, certains effets dévastateurs peuvent résulter des chirurgies dentaires, notamment l'angine de Ludwig, la médiastinite, l'hémorragie, la fasciite nécrosante, le syndrome de Lemierre et l'ostéomyélite. L'ostéomyélite est une complication rare, mais bien connue, de l'extraction dentaire, qui peut imiter de nombreux processus bénins et malins. Dans cette étude de cas, nous passons en revue le diagnostic et la prise en charge d'un cas avancé d'ostéomyélite mandibulaire postopératoire qui est apparue à la suite de l'extraction d'une troisième molaire inférieure.
Introduction
Les dentistes sont familiers avec plusieurs complications rares des chirurgies de la troisième molaire, notamment l'angine de Ludwig, la médiastinite, l'hémorragie, la fasciite nécrosante et le syndrome de Lemierre1-4. Dans cette étude de cas, nous passons en revue le diagnostic et la prise en charge d'un cas avancé d'ostéomyélite mandibulaire consécutive à l'extraction d'une troisième molaire inférieure et examinons la symptomatologie non spécifique de cette affection.
Étude de cas
La dent 48 d'une femme de 29 ans en bonne santé a été extraite par un dentiste généraliste après la prise en charge d'une péricoronarite. Une semaine plus tard, une soudaine hémorragie abondante s'est produite au site opératoire, mais a rapidement été maîtrisée par l'application d'une pression directe. À partir de ce moment, la patiente a commencé à ressentir une douleur diffuse et à présenter une légère tuméfaction au niveau du maxillaire inférieur postérieur droit. La tuméfaction était intermittente, mais la douleur était constante; la prise de kétorolac par voie orale procurait toutefois un soulagement adéquat. La patiente a décrit la douleur comme une douleur vive qui s'étendait de l'oreille ipsilatérale jusqu'au menton et, vers le bas, jusqu'au bord inférieur du maxillaire inférieur. Le dentiste a posé un diagnostic initial de douleur myofaciale et de capsulite de l'articulation temporomandibulaire (ATM) droite.
Environ 3 mois après l'extraction, la patiente a été dirigée vers un chirurgien buccal et maxillofacial, car la douleur et la tuméfaction étaient toujours présentes. Sur la base des antécédents et des examens radiographique et clinique, lesquels ont révélé une lésion mandibulaire ostéolytique avec tuméfaction dans le vestibule buccal adjacent au siège de la dent 48 et dans la région sous-mandibulaire droite, le diagnostic a été changé pour ostéomyélite purulente chronique. Un traitement d'un mois associant la prise de pénicilline et de métronidazole par voie orale a été prescrit à la patiente. Ce traitement a permis de réduire considérablement la douleur, mais la tuméfaction et la sensibilité dans les zones sous-mandibulaire et sous-massétérine droites étaient toujours présentes. L'antibiothérapie a donc été prolongée d'un mois, cette fois-ci par la prise de clindamycine par voie orale.
Six mois après la procédure initiale, la patiente a passé une imagerie plus poussée visant à évaluer une cavité médullaire dense de l'os dans la mandibule droite, mise en évidence sur une radiographie panoramique (ill. 1). La tomodensitométrie et la résonance magnétique ont confirmé la présence d'une ostéomyélite diffuse avec atteinte du corps droit du maxillaire inférieur (ill. 2). Aucun séquestre n'était visible à la radiographie. À ce stade, l'ouverture interincisive maximale de la patiente avait été réduite à 20 mm. Les analyses sanguines, y compris la formule leucocytaire, ne montraient rien de particulier.
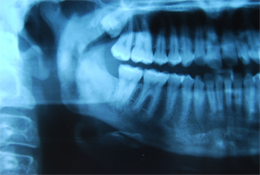 Ill. 1: Radiographie panoramique du processus ostéomyélitique associé au corps, à la branche montante et au condyle du maxillaire inférieur droit.
Ill. 1: Radiographie panoramique du processus ostéomyélitique associé au corps, à la branche montante et au condyle du maxillaire inférieur droit.
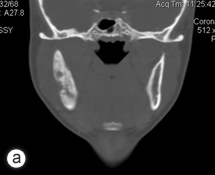
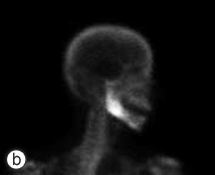
Ill. 2 : Tomodensitométrie : vue frontale (a); scintigraphie osseuse au technétium 99 (b) et reconstruction tridimensionnelle (c) illustrant le processus ostéomyélitique du maxillaire inférieur droit.
De la moxifloxacine a été ajoutée à l'antibiothérapie de la patiente, en raison de la persistance de l'ostéomyélite purulente chronique, et 20 séances d'oxygénothérapie hyperbare (OHB) lui ont été prescrites. Ces dernières ont débuté 11 mois après l'extraction de la dent 48.
L'OHB n'a toutefois procuré que des bienfaits temporaires et, au cours des mois qui ont suivi, la patiente a continué de ressentir des malaises, un trismus et de l'œdème passagers dans la région mandibulaire droite. Comme les symptômes continuaient d'évoluer, la patiente a été admise à l'hôpital à plusieurs reprises pour y recevoir une antibiothérapie intraveineuse et subir un débridement localisé sous anesthésie générale. Malheureusement, son état clinique a continué de se dégrader et, 18 mois après l'extraction, elle a de nouveau été hospitalisée : la patiente était fébrile et ressentait une douleur intense associée à une infection des espaces masticatoire et buccal droits. Une nouvelle imagerie a révélé que le processus ostéomyélitique atteignait maintenant la majeure partie de la branche montante et du corps du maxillaire inférieur jusqu'au niveau mésial de la dent 46.
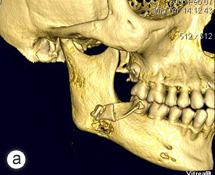
Après avoir longuement discuté avec la patiente, il a été décidé de procéder à une résection de la portion atteinte du maxillaire inférieur. L'intervention a consisté en la résection de l'os sclérotique, y compris du condyle, de la branche montante et d'une portion du corps du maxillaire inférieur droit. Les dents 45, 46 et 47 ont aussi été incluses dans la résection, laquelle a été prolongée jusqu'à ce qu'on atteigne la moelle osseuse saine – signe d'un tissu osseux sain. La reconstruction provisoire a consisté en la mise en place d'une plaque de reconstruction portante sur laquelle a été fixée une tête de condyle prothétique (ill. 3). La patiente s'est très bien rétablie après l'intervention et tous les symptômes associés à l'infection ont rapidement disparu (ill. 4). Après la résection, l'antibiothérapie a été poursuivie pendant 3 mois, moment auquel tous les symptômes de l'ostéomyélite avaient disparu.
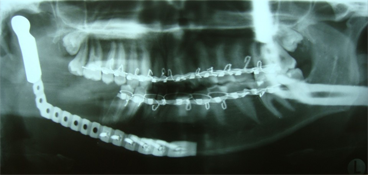 Ill. 3 : Radiographie panoramique du maxillaire inférieur droit réséqué et de la plaque de reconstruction portante avec tête de condyle prothétique.
Ill. 3 : Radiographie panoramique du maxillaire inférieur droit réséqué et de la plaque de reconstruction portante avec tête de condyle prothétique.
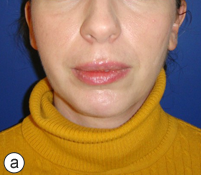
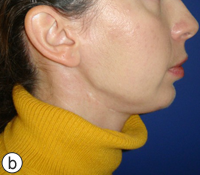
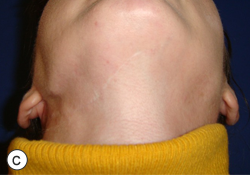
Ill. 4 : Photographies postopératoires montrant un résultat esthétique adéquat sur les vues frontale (a) et de profil (b). Le plan en contre-plongée (c) montre l'angle mandibulaire proéminent associé à la reconstruction provisoire à l'aide d'une plaque portante.
Un an et demi après la résection mandibulaire, la mandibule droite de la patiente a été reconstruite à l'aide d'une allogreffe osseuse déminéralisée et lyophilisée servant de support à l'os autogène prélevé de la crête iliaque postérieure (ill. 5). Le maxillaire inférieur allogénique a été évidé et rempli d'os autogène particulaire. Six mois après la reconstruction, la greffe osseuse montrait des signes cliniques et radiographiques de consolidation et la patiente demeurait exempte de signes et de symptômes d'ostéomyélite (ill. 6). L'occlusion finale était acceptable et la restauration sur implant des dents manquantes devrait être entreprise prochainement (ill. 7).
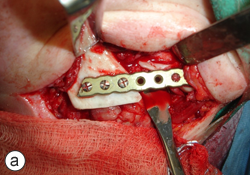
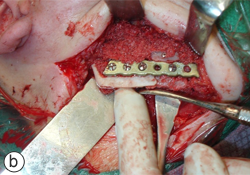
Ill. 5 : Reconstruction mandibulaire finale avec une grille mandibulaire allogénique déminéralisée et lyophilisée prélevée d'un donneur décédé (a) et un greffon spongieux particulaire autogène (b).
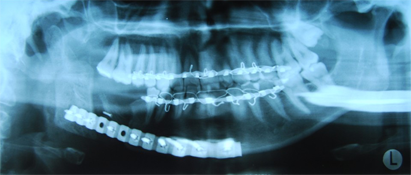 Ill. 6 : Radiographie panoramique du maxillaire inférieur reconstruit avec une grille mandibulaire prélevée d'un donneur décédé et un greffon spongieux particulaire autogène.
Ill. 6 : Radiographie panoramique du maxillaire inférieur reconstruit avec une grille mandibulaire prélevée d'un donneur décédé et un greffon spongieux particulaire autogène.
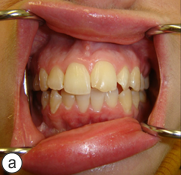
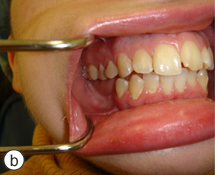
Ill. 7 : La malocclusion de classe I et la relation de la ligne médiane préopératoires ont été rétablies (a). La quantité de tissus mous et de tissus osseux dans le maxillaire inférieur postérieur droit est suffisante pour permettre une restauration ultérieure sur implants (b).
Discussion
Le dentiste généraliste est habituellement le premier professionnel de la santé appelé à évaluer des maladies buccales, en particulier celles qui se rapportent aux zones dentées. L'ostéomyélite est une complication relativement rare de l'extraction dentaire, qui peut imiter de nombreux processus bénins et malins. Afin d'assurer un triage et un traitement efficaces de ces patients, le dentiste doit avoir une compréhension pratique des signes et des symptômes associés à l'ostéomyélite.
L'ostéomyélite est une maladie inflammatoire infectieuse des os, causée par la colonisation bactérienne de la moelle osseuse. Sa pathophysiologie est liée à l'accumulation d'un exsudat inflammatoire dans la cavité médullaire osseuse et sous le périoste, qui a pour effet de comprimer l'apport sanguin central (sinusoïde) et périphérique de l'os. À la longue, l'apport sanguin osseux est altéré, ce qui réduit l'apport de nutriments et d'oxygène. Le remodelage osseux nécessaire à la régénération est également compromis. Les tissus nécrosés favorisent la prolifération des bactéries ce qui, sans traitement approprié, causera une guérison incomplète et la progression de l'ostéomyélite.
L'ostéomyélite se manifeste en 2 phases : une phase précoce ou aiguë qui est habituellement purulente et une phase chronique plus tardive, qui peut être purulente. L'affection chronique est en général d'une durée supérieure à un mois et est attribuable soit à une réponse insuffisante au traitement initial, soit à une défense inadéquate de l'hôte.
Dans les os longs, l'ostéomyélite a été associée à l'introduction iatrogène de Staphylococcus aureus et S. epidermis durant une chirurgie ou un traumatisme. La propagation hématogène des bactéries dans l'os est également bien documentée5. Dans les zones dentées, toutefois, l'ostéomyélite est habituellement polymicrobienne. L'abondance de la flore buccale microbienne et les possibilités qu'a cette flore de traverser la barrière muqueuse créent des conditions favorables à l'envahissement du tissu osseux par des pathogènes, comme les streptocoques et autres pathogènes opportunistes. Dans les formes réfractaires d'ostéomyélite des mâchoires, les espèces Actinomyces et Eikenella deviennent plus répandues à mesure que le processus infectieux progresse et s'isole des mécanismes de défense de l'hôte6. Ces organismes peuvent dominer lorsqu'un traitement sous-optimal ne réussit pas à éradiquer les pathogènes potentiels durant les premières tentatives thérapeutiques.
L'OHB a été utilisée comme traitement d'appoint au début de la prise en charge de cette patiente. L'OHB a pour but d'augmenter la tension en oxygène dans les plaies hypoxiques, ce qui améliore la prolifération vasculaire et l'activité fibroblastique et stimule l'activité ostéoclastique7,8. La capacité des leucocytes de détruire les bactéries augmente également dans les tissus où la tension en oxygène est plus élevée9. Dans l'ensemble, les avantages de l'OHB en justifient l'utilisation comme traitement d'appoint à la chirurgie et au traitement antimicrobien dans la prise en charge de l'ostéomyélite purulente chronique et de l'ostéomyélite réfractaire sclérosante chronique10.
Le cas décrit précédemment illustre les caractéristiques typiques de l'ostéomyélite purulente chronique. Durant la prise en charge de cette patiente, l'antibiothérapie et les traitements non chirurgicaux ont été utilisés sans succès. Des antibiotiques à large spectre ont été administrés pour lutter contre Actinomyces et Eikenella. L'OHB d'appoint a procuré un soulagement temporaire de la douleur. Le traitement chirurgical initial a consisté en une séquestrectomie et une décortication associées à un traitement antimicrobien intraveineux, mais ce traitement n'a eu qu'un succès limité. Cette procédure est toutefois compatible avec les protocoles publiés par d'autres10-12. Lorsque les procédures moins invasives échouent, une résection partielle avec reconstruction par étapes s'est révélée efficace pour traiter l'ostéomyélite réfractaire13, comme ce fut le cas ici.
LES AUTEURS
Références
- Sandor GK, Low DE, Judd PL, Davidson RJ. Antimicrobial treatment options in the management of odontogenic infections. J Can Dent Assoc. 1998;64(7):508-14.
- Moghadam HG, Caminiti MF. Life-threatening hemorrhage after extraction of third molars: case report and management protocol. J Can Dent Assoc. 2002;68(11):670-4.
- Fenton CF, Kertesz T, Baker G, Sándor GK. Necrotizing fasciitis of the face: a rare but dangerous complication of dental infection. J Can Dent Assoc. 2004;70(9):611-5.
- Albilia JB, Humber CC, Clokie CM, Sándor GK. Lemierre syndrome from an odontogenic source: a review for dentists. J Can Dent Assoc. 2010;76:a47.
- Mader JT, Shirtliff ME, Bergquist SC, Calhoun J. Antimicrobial treatment of chronic osteomyelitis. Clin Orthop Relat Res. 1999;(360):47-65.
- Marx RE, Carlson ER, Smith BR, Toraya N. Isolation of Actinomyces species and Eikenella corrodens from patients with chronic diffuse sclerosing osteomyelitis. J Oral Maxillofac Surg. 1994;52(1):26-33; discussion 33-4.
- Triplett RG, Branham GB, Gillmore JD, Lorber M. Experimental mandibular osteomyelitis: therapeutic trials with hyperbaric oxygen. J Oral Maxillofac Surg. 1982;40(10):640-6.
- Gill AL, Bell CN. Hyperbaric oxygen: its uses, mechanisms of action and outcomes. QJM. 2004;97(7):385-95.
- Hohn DC. Oxygen and leukocyte microbial killing. In: Davis JC, Hunt, TK, editors. Hyperbaric oxygen therapy. Bethesda, Md.: Undersea Medical Society Inc.; 1977. p. 101-10.
- van Merkesteyn JP, Groot RH, van den Akker HP, Bakker DJ, Borgmeijer-Hoelen AM. Treatment of chronic suppurative osteomyelitis of the mandible. Int J Oral Maxillofac Surg. 1997;26(6):450-4.
- Kim SG, Jang HS. Treatment of chronic osteomyelitis in Korea. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2001;92(4):394-8.
- Koorbusch GF, Fotos P, Goll KT. Retrospective assessment of osteomyelitis. Etiology, demographics, risk factors, and management in 35 cases. Oral Surg Oral Med Oral Pathol. 1992;74(2):149-54.
- Suei Y, Tanimoto K, Miyauchi M, Ishikawa T. Partial resection of the mandible for the treatment of diffuse sclerosing osteomyelitis: report of four cases. J Oral Maxillofac Surg. 1997;55(4):410-4; discussion 414-5.
