Sommaire
Objectif : Cette série de cas rend compte de la guérison à court et à long termes, avant et après la mise en place d'un implant, de sites d'extraction au maxillaire inférieur postérieur qui ont été traités par un mélange d'allogreffe de matrice osseuse déminéralisée et lyophilisée (demineralized, freeze-dried bone matrix [DFDBM]) et d'un liant de sulfate de calcium.
Méthodologie : Une perte partielle de la plaque osseuse buccale au site d'extraction a été observée chez 3 patients qui avaient subi l'extraction chirurgicale d'une molaire inférieure postérieure. Une reconstruction de l'os alvéolaire par une allogreffe de DFDBM mélangée à un liant de sulfate de calcium a été réalisée sur-le-champ et la greffe a été recouverte d'une membrane de régénération biodégradable. Chez ces 3 patients, l'implant et le pilier de guérison ont été mis en place respectivement après 6, 9 et 12 mois, et la couronne a été mise en place respectivement 3, 5 et 5 mois plus tard. Les implants ont fait l'objet d'une réévaluation clinique et radiographique régulière durant la période de 10 à 39 mois suivant l'insertion finale de la couronne. La stabilité biologique et fonctionnelle à long terme des implants a été évaluée à l'aide d'un dispositif de mesure de la stabilité de l'implant.
Résultats : Au moment de l'exposition et de la mise en place de l'implant, la crête alvéolaire greffée chez tous les patients présentait une masse osseuse dense, bien vascularisée et de bonnes dimensions, suffisamment large pour recevoir l'implant à large plate-forme prévu. Le quotient de stabilité de l'interface à long terme a varié de 87 à 90.
Conclusions : Les sites d'extraction au maxillaire inférieur postérieur, dans lesquels il y a eu atteinte de l'os alvéolaire buccal, peuvent être traités efficacement par une augmentation alvéolaire immédiate réalisée avec un mélange d'allogreffe de DFDBM et d'un liant de sulfate de calcium. Cette démarche permet d'obtenir la forme et la consistance alvéolaires idéales en vue de la mise en place éventuelle d'un implant.
Introduction
La technique de reconstruction à utiliser pour corriger un déficit osseux alvéolaire après une extraction est une question qui intéresse les dentistes généralistes et les spécialistes en implantologie intra-osseuse, qui se demandent notamment s'il vaut mieux pratiquer la greffe au moment de l'extraction pour éviter le risque de guérison médiocre de l'os (qui nécessiterait une greffe au moment de la mise en place de l'implant). Et si une greffe doit être pratiquée, vaut-il mieux utiliser un matériau de greffe osseuse autogène, allogène, xénogène ou synthétique, ou une combinaison de ces produits, pour la reconstruction?
La matrice osseuse déminéralisée Accell Connexus, qui se présente sous forme de mastic (Citagenix Inc., Laval, QC), est composée dans une proportion de 70 % (en poids) d'une matrice osseuse allogène déminéralisée et lyophilisée (demineralized, freeze-dried bone matrix [DFDBM]). Ce produit renferme également des protéines morphogénétiques osseuses (BMP) humaines, plus spécifiquement les protéines BMP-2, BMP-4 et BMP-7, ainsi qu'un facteur de croissance transformant bêta 1. Toutes ces substances sont importantes pour le processus de guérison osseuse1. La moitié de la DFDBM reste sous forme de particules et le reste subit une solubilisation qui produit un support fluide ayant un potentiel d'ostéoinduction2. Ce matériau a donc une capacité d'ostéoinduction1,3,4. La matrice Accell Connexus renferme également 30 % (en poids) d'un médium en phase inversée. Lorsque le support inerte vient en contact avec la salive et le sang à la température corporelle, durant la chirurgie, il confère à la DFDBM une plus grande densité et une meilleure résistance au déplacement durant le compactage dans le site d'extraction.
Le liant pour greffe osseuse CalMatrix (Citagenix Inc.) est un composé synthétique qui a la consistance du mastic et qui contient du sulfate de calcium hémihydrate α, de la carboxyméthylcellulose sodique et une solution hydratante.
Auparavant, l'évaluation de l'ostéointégration biologique à long terme des implants dentaires était basée sur les facteurs cliniques suivants : absence de douleur, présence d'un bruit sourd à la percussion verticale de l'implant, stabilité de l'implant à un couple inverse de 20 Ncm et absence d'inflammation des tissus mous péri-implantaires et de pathologie osseuse à la radiographie rétroalvéolaire1. Il existe aujourd'hui des appareils qui permettent au clinicien d'évaluer de façon objective la stabilité mécanique d'un implant au moment de sa mise en place et durant le suivi. Ces appareils (p. ex. Osstell ISQ, Osstell AB, Göteborg, Suède) attribuent une valeur numérique de stabilité, désignée sous le nom de quotient de stabilité à l'interface (ISQ). La valeur ISQ, qui a été présentée pour la première fois en 1996 par Meredith et ses collègues5, est basée sur l'analyse de la fréquence de résonance. Un implant dont l'ostéointégration biologique est réussie doit avoir une valeur ISQ supérieure ou égale à 57; une valeur inférieure à 57 indique un risque accru d'échec de l'implant.
Cette série de cas décrit 3 patients chez qui un mélange constitué de la matrice osseuse en mastic Accell Connexus et du liant pour greffe osseuse CalMatrix – qui lorsque combinés ont un potentiel ostéoconducteur et ostéoinducteur – a été utilisé immédiatement après l'extraction pour reconstruire la crête alvéolaire avant la mise en place d'un implant dans le secteur postérieur.
Techniques opératoires et résultats
Trois patients ont consulté pour le traitement d'une pathologie périapicale chronique ou d'une bifurcation osseuse au niveau d'une molaire postérieure inférieure (ill. 1 et 2), avec ankylose ou fracture radiculaire. Les 3 patients avaient subi une extraction avec élévation d'un lambeau sulculaire mucopériosté, ostectomie partielle et odontectomie complète. Après l'extraction, les tissus de granulation résiduels ont été éliminés et une greffe a été pratiquée immédiatement dans le site d'extraction en utilisant un mélange de DFDBM allogène et de sulfate de calcium synthétique (ill. 3a et 3b). Cette étape a permis d'éviter d'avoir à prélever des greffons osseux autogènes. Chez chaque patient, le site de la greffe a été recouvert d'une membrane de collagène xénogène résorbable de type I (Neomem, Citagenix Inc.) (ill. 3c), puis il y a eu suture primitive de la plaie. Toutes les procédures ont été exécutées par le même chirurgien (A.-J.C.).
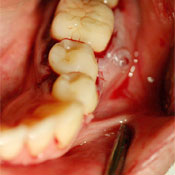 Ill. 1 : Patient 3. Vue préopératoire de la dent 36 montrant une zone fistuleuse chronique au niveau de la bifurcation buccale.
Ill. 1 : Patient 3. Vue préopératoire de la dent 36 montrant une zone fistuleuse chronique au niveau de la bifurcation buccale.
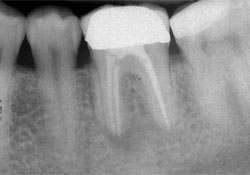 Ill. 2 : Patient 3. La radiographie rétroalvéolaire préopératoire de la dent 36 montre une zone radioclaire dans les régions de la bifurcation et de la racine mésiale.
Ill. 2 : Patient 3. La radiographie rétroalvéolaire préopératoire de la dent 36 montre une zone radioclaire dans les régions de la bifurcation et de la racine mésiale.
 Ill. 3 : Patient 3. Vue postopératoire après l'extraction de la dent 36 montrant a) des déficits osseux dans la zone mésio-buccale, celle de la bifurcation et la zone interradiculaire; b) la greffe; c) la membrane de régénération sur le site de la greffe.
Ill. 3 : Patient 3. Vue postopératoire après l'extraction de la dent 36 montrant a) des déficits osseux dans la zone mésio-buccale, celle de la bifurcation et la zone interradiculaire; b) la greffe; c) la membrane de régénération sur le site de la greffe.
Chez le patient 1, le site opératoire a été exposé après 6 mois, le patient 2 après 9 mois et le patient 3 après 12 mois. Chez ces 3 patients, une guérison clinique de l'os a été observée au moment de l'exposition, la crête alvéolaire greffée présentant une densité et une vascularité adéquates ainsi qu'une largeur suffisante pour la mise en place, sans autre greffe osseuse, de l'implant postérieur à large plate-forme prévu et d'un pilier de guérison. Le traitement de restauration fonctionnelle final a été réalisé par le même prosthodontiste (H.C.), 3 mois (patient 1) ou 5 mois (patients 2 et 3) après la pose de l'implant et du pilier de guérison (ill. 4).
La stabilité a été évaluée à l'aide du dispositif de mesure Osstell ISQ (Citagenix Inc.) au moment du suivi postopératoire effectué 39 mois (patient 1) ou 33 mois (patient 3) après le rétablissement intégral de la fonction occlusale. Les valeurs ISQ ont varié de 87 à 90, indiquant une bonne stabilité. Aucune évaluation ISQ n'a été faite chez le patient 2, car celui-ci avait reçu une restauration collée. L'évaluation clinique des 3 implants a révélé la présence d'un bruit sourd à la percussion verticale de l'implant, une stabilité à l'application d'un couple inverse de 20 Ncm, ainsi que l'absence d'inflammation des tissus mous autour de l'implant restauré et de pathologie osseuse péri-implantaire à l'évaluation radiographique1. Il a donc été conclu que les 3 implants étaient biologiquement, fonctionnellement et esthétiquement stables (ill. 4 et 5). Le tableau 1 résume les résultats de ces 3 cas.
 Ill. 4 : Patient 3. Aspect du traitement de restauration terminé, 5 mois après la pose de l'implant et du pilier de guérison dans la région de la dent 36.
Ill. 4 : Patient 3. Aspect du traitement de restauration terminé, 5 mois après la pose de l'implant et du pilier de guérison dans la région de la dent 36.
 Ill. 5 : Patient 3. Radiographie rétroalvéolaire de l'implant et de la restauration, 50 mois après l'extraction chirurgicale de la dent 36 et la greffe immédiate, 38 mois après la pose de l'implant et du pilier de guérison et 33 mois après la restauration. On remarque une bonne densité osseuse tout autour de la surface de l'implant, y compris une partie du col lisse.
Ill. 5 : Patient 3. Radiographie rétroalvéolaire de l'implant et de la restauration, 50 mois après l'extraction chirurgicale de la dent 36 et la greffe immédiate, 38 mois après la pose de l'implant et du pilier de guérison et 33 mois après la restauration. On remarque une bonne densité osseuse tout autour de la surface de l'implant, y compris une partie du col lisse.
Tableau 1 : Résumé de 3 cas d'extractions au maxillaire inférieur postérieur qui ont été suivies d'une greffe de matrice osseuse déminéralisée
| Patient | No de la dent (taille de l'implanta, mm) |
Délai avant la mise en place de l'implantb
(mois) |
Délai avant la pose de la couronnec
(mois) |
Période de mise en fonction de la couronne (mois) |
Valeurs ISQd à la dernière visite
(MD, BL) |
| 1 | 46 (5 × 13) | 6 | 3 | 39 | 87, 88 |
| 2 | 36 (5 × 10) | 9 | 5 | 10 | Évaluation clinique seulement |
| 3 | 36 (6 × 13) | 12 | 5 | 33 | 88, 90 |
BL = valeur bucco-linguale, ISQ = quotient de stabilité à l'interface, MD = valeur mésio-distale
aTaille de l'implant, exprimée en diamètre × longueur.
bÀ partir de la date de l'extraction et de la greffe.
cÀ partir de la mise en place de l'implant et du pilier de guérison.
dUne valeur ISQ supérieure ou égale à 57 indique un implant dont l'ostéointégration est biologiquement réussie; une valeur ISQ < 57 indique un risque accru d'échec de l'implant.
Discussion
Même en l'absence de complications, la résorption osseuse aux sites d'extraction survient surtout dans les 6 à 12 mois qui suivent l'extraction et est plus marquée sur la plaque buccale que sur la plaque linguale de l'os alvéolaire6-9. La résorption osseuse au site d'extraction est également jusqu'à 4 fois plus rapide au maxillaire inférieur que supérieur6. De plus, la guérison tridimensionnelle finale de la crête alvéolaire est imprévisible et varie d'un patient à l'autre, ce qui peut compromettre fortement le succès de l'implant dentaire9-12. Enfin, les profils de résorption sont encore plus prononcés après une exodontie compliquée, de sorte que le futur site de l'implant sera encore plus compromis. Par conséquent, dans les cas d'extraction précédant la mise en place d'un implant, le dentiste doit sérieusement examiner les avantages d'une reconstruction immédiate du site d'extraction par greffe osseuse, un procédé qui offre un potentiel de guérison osseuse dans les 3 dimensions. Une telle intervention, notamment dans la région du maxillaire inférieur postérieur, permettrait d'obtenir une crête alvéolaire de forme plus prévisible, tant sur les plans qualitatif que quantitatif, ce qui permettrait en retour la mise en place en une étape d'un implant à large plate-forme et d'un pilier de guérison, une restauration qui répondrait mieux aux exigences précises à respecter pour assurer une réhabilitation sur implant biologiquement fonctionnelle et esthétique dans cette région7,9,13-16.
L'autogreffe osseuse, avec ses propriétés ostéogènes, ostéoinductives et ostéoconductrices favorables, demeure la référence en matière de greffe osseuse17. Les allogreffes osseuses présentent toutefois d'importants avantages, qui ont trait notamment à leur quantité illimitée et à leur variété de formes (p. ex. mastic, particules, gel)4. De plus, le patient n'a pas à subir de deuxième intervention (zone donneuse), laquelle augmente la morbidité chez les patients (dans une proportion estimée entre 8 % et 10 %)16,18-20.
Cependant, les allogreffes osseuses ont aussi certains inconvénients, dont le risque de transmission de maladies21. Ce risque a toutefois été estimé à seulement 1 sur 2,8 milliards lorsqu'on utilise une DFDBM qui a fait l'objet d'une préparation et d'analyses rigoureuses3. Le rejet de la greffe – autre inconvénient possible – dépend principalement de la réaction immunitaire du patient. Cependant, la lyophilisation et la déminéralisation réduisent considérablement l'antigénicité de la matrice osseuse allogène, et le rejet de ce type de greffe est rare22.
Le potentiel de résorption lente, le degré variable de remplacement par de l'os vivant et la persistance de particules de greffe non résorbées sont d'autres facteurs liés aux greffes de DFDBM qui doivent être pris en considération23. Froum et ses collègues24 ont comparé la guérison de sites d'extraction obturés avec du bioverre ou une DFDBM à la guérison de sites non obturés. Après une période de guérison de 6 à 8 mois, la proportion d'os vivant (en volume) a été de 59,5 % dans les sites d'extraction obturés avec du bioverre, de 34,7 % pour ceux obturés avec la DFDBM et de 32,4 % dans les sites d'extraction non obturés. Dans les sites d'extraction obturés, les particules résiduelles à l'intérieur des sites greffés ont représenté 5,5 % (en volume) avec le bioverre et 13,5 % (en volume) dans le cas de la DFDBM.
À l'inverse, durant une étude de cas clinique prospective, Babbush25 a constaté que la proportion d'os vivant dans les sites d'extraction obturés avec la DFDBM était supérieure au taux observé par Froum et ses collègues24. Babbush a évalué la guérison des sites d'extraction de 10 patients chez qui l'extraction d'une dent unique avait été suivie immédiatement d'une allogreffe osseuse, puis de la mise en place d'un implant de 4 à 21 mois plus tard. Au moment de la pose de l'implant, la biopsie osseuse a révélé que l'os hôte vivant représentait en moyenne 57,5 % (en volume) du matériau dans le site de la greffe. Dans tous les cas, les sites greffés ont pu soutenir la mise en place d'un implant et la mise en charge finale de la prothèse, sans échec ni complications. Il a été conclu que, si une allogreffe osseuse est pratiquée immédiatement dans le site d'extraction, un implant peut être mis en place dès 4 mois après l'intervention, et seules quelques particules de matériau non intégré demeurent présentes.
Parmi les facteurs qui pourraient expliquer la variabilité de ces résultats, mentionnons les propriétés biologiques inhérentes de la greffe, les critères de sélection des patients, la gravité des déficits osseux dans les sites d'extraction, les matériaux de support de la DFDBM, les aptitudes du chirurgien26,27 ainsi que la quantité et les sous-types de protéines osseuses minéralisées dans chaque allogreffe3,28.
Le coût élevé de ces matériaux doit être considéré comme un inconvénient possible.
Conclusions
Dans les cas comme ceux décrits ici, la résorption osseuse tridimensionnelle et le remodelage osseux sont inévitables. La résorption se produit surtout durant les 6 à 12 premiers mois suivant l'extraction de la dent, même en l'absence de complications, et elle est encore plus prononcée dans les cas d'exodontie complexe. Qui plus est, la résorption et le remodelage sont jusqu'à 4 fois plus rapides lorsque l'extraction est pratiquée au maxillaire inférieur qu'au maxillaire supérieur – surtout sur la plaque buccale de l'os alvéolaire – et ceci peut fortement compromettre la mise en place de l'implant. La réalisation immédiate d'une greffe dans le site d'extraction est probablement le moyen le plus prévisible de préserver et peut-être même d'accroître la qualité de l'os alvéolaire résiduel et sa quantité29. Les avantages de cette technique résident dans l'exploitation du potentiel de guérison tridimensionnelle de l'os alvéolaire et dans l'intégration éventuelle du greffon dans l'architecture osseuse homologue du maxillaire supérieur ou inférieur.
Bien que les autogreffes osseuses demeurent la référence, les milieux scientifiques et cliniques s'intéressent de plus en plus aux allogreffes osseuses, dont certains résultats s'annoncent prometteurs en ce qui a trait à l'excellence de la qualité et de la quantité osseuses obtenues pour la mise en place ultérieure d'un implant25,30,31. Cette technique offre divers avantages qui ont trait notamment à l'offre illimitée de matériaux de greffe et à la variété des formes disponibles, ainsi qu'à l'élimination d'un deuxième site opératoire. Ses inconvénients sont liés à l'absence de composantes ostéogènes et ostéoconductrices, au risque de transmission de maladies et de rejet et à la lente résorption de la greffe. Cependant, l'ajout d'un liant synthétique à l'allogreffe de DFDBM peut lui conférer un potentiel d'ostéoconduction. De plus, l'utilisation d'une allogreffe osseuse lyophilisée et déminéralisée réduit considérablement l'antigénicité du produit et le risque de transmission de maladies.
Cette série de cas montre que des résultats cliniques favorables ont été observés chez 3 patients chez qui une greffe et une reconstruction ont été pratiquées immédiatement après l'extraction dans le site compromis (après l'extraction d'une molaire inférieure postérieure), en utilisant un mélange fait d'une allogreffe de DFDBM et d'un liant synthétique. Cette technique a favorisé la guérison de l'os alvéolaire résiduel dans les 3 dimensions, ce qui a contribué à la formation d'une crête alvéolaire large, dense et bien vascularisée et à l'absence de déhiscence osseuse au site de l'implant. Ces facteurs ont permis au chirurgien de mettre en place en une étape un implant à large plate-forme et un pilier de guérison aux endroits prévus sur le gabarit chirurgical pour chacun de ces patients, sans avoir à pratiquer de greffe osseuse supplémentaire. L'utilisation d'un implant à large plate-forme a permis d'obtenir un profil d'émergence plus esthétique et une plus grande résistance aux forces occlusales postérieures à long terme (ill. 4 et 5).
L'évaluation clinique d'un plus grand nombre de patients subissant des procédures comparables sera nécessaire pour confirmer ou réfuter la conclusion voulant que – sous réserve d'une sélection adéquate des patients et d'une bonne exécution de la technique – la mise en place d'une allogreffe de DFDBM combinée à un liant synthétique offre une excellente solution de rechange à l'autogreffe osseuse et donne une guérison osseuse prévisible dans les 3 dimensions.
LES AUTEURS
Références
- Boyan BD, Kinney RC, Singh K, Williams JK, Cillo Y, Schwartz Z. Bone morphogenetic proteins and other bone growth factors. In: Orthopedic biology and medicine: musculoskeletal tissue regeneration, biological materials and methods. Pietrzak WS, editor. Totowa (NJ): Humana Press; 2008. p. 225-245.
- Kay JF, Khaliq S, King E. Osteoinduction of carriers for DBM-based bone graft materials: BMP and growth factor analyses. White Paper for IsoTis OrthoBiologics. October 2005.
- Keith JD Jr, Salama MA. Ridge preservation and augmentation using regenerative materials to enhance implant predictability and esthetics. Compend Contin Educ Dent. 2007;28(11):614-21.
- Hoexter DL. Bone regeneration graft materials. J Oral Implantol. 2002;28:290-94.
- Meredith N, Alleyne D, Cawley P. Quantative determination of the stability of the implant-tissue interface using resonance frequency analysis. Clin Oral Implants Res. 1996;7(3):261-7.
- Atwood DA, Coy WA. Clinical cephalometric and densitometric study of reduction of residual ridges. J Prosthet Dent. 1971;26(3):280-95.
- Iasella JM, Greenwell H, Miller M, Hill M, Drisko C, Bohra AA, Scheetz JP. Ridge preservation with freeze-dried bone allograft and a collagen membrane compared to extraction alone for implant site development: a clinical and histologic study in humans. J Periodontol. 2003;74(7):990-9.
- Sobolik CF. Alveolar bone resorption. J Prosthet Dent. 1960;10:612-9.
- Irinakis T, Tabesh M. Preserving the socket dimensions with bone grafting in single sites: an esthetic surgical approach when planning delayed implant placement. J Oral Implantol. 2007;33(3):156-63.
- Mecall RA, Rosenfeld AL. Influence of residual ridge resorption patterns on implant fixture placement and tooth position. 1. Int J Periodontics Restorative Dent. 1991;11(1):8-23.
- Drakos D, Engler-Hamm D. Ridge preservation: why and when. Implants. 2006;3:20-3. Available: www.fachpraxis.de/pdf/fortbildungen/PDF14.pdf (consulté le 17 janvier 2012).
- Sonick M, Hwang D. Tooth extraction – an opportunity for site preservation. Contemp Esthetics. 2007;11(2):38-43.
- Zubilliga G, Von Hagen S, Simon BI, Deasy MJ. Changes in alveolar bone height and width following post-extraction ridge augmentation using a fixed bioabsorbable membrane and demineralized freeze-dried bone osteoinductive graft. J Periodontol. 2003;74(7):965-75.
- Perrot DH, Smith RA, Kaban LB. The use of fresh frozen allogenic bone for maxillary and mandibular reconstruction. Int J Oral Maxillofacial Surg. 1992;21(5):260-5.
- Present S, Levine RA. Single maxillary tooth restoration. Inside Dentistry. 2010;6(1):58-66.
- Jackson BJ, Morcos I. Socket grafting: a predictable technique for site preservation. J Oral Implantol. 2007;33(6):353-64.
- Moy PK. Alveolar ridge reconstruction with preprosthetic surgery: a precursor to site preservation following extraction of natural dentition. Oral Maxillofac Surg Clin North Am. 2004;16(1):1-7.
- Gomes KU, Carlini JL, Biron C, Rapoport A, Dedivitis RA. Use of allogenic bone graft in maxillary reconstruction for installation of dental implants. J Oral Maxillofac Surg. 2008;66(11):2335-8.
- Clokie CM, Moghadam H, Jackson MT, Sandor GK. Closure of critical sized defects with allogenic and alloplastic bone substitutes. J Craniofac Surg. 2002;13(1):111-21.
- Younger EM, Chapman MW. Morbidity at bone graft donor sites. J Orthop Trauma. 1989;3(3):192-5.
- Marx RE, Carlson ER. Tissue banking safety: caveats and precautions for the oral and maxillofacial surgeon. J Oral Maxillofac Surg. 1993;51(12):1372-9.
- Cypher TJ, Grossman JP. Biological principles of bone graft healing. J Foot Ankle Surg. 1996;35(5):413-7.
- Becker W, Urist M, Becker BE, Jackson W, Parry DA, Bartold M, et al. Clinical and histologic observations of sites implanted with intraoral autologous bone grafts or allografts. 15 human case reports. J Periodontol. 1996;67(10):1025-33.
- Froum S, Cho SC, Rosenberg E, Rohrer M, Tarnow D. Histological comparison of healing extraction sockets implanted with bioactive glass or demineralized freeze-dried bone allograft: a pilot study. J Periodontol. 2002;73(1):94-102.
- Babbush CA. Histologic evaluation of human biopsies after dental augmentation with a demineralized bone matrix putty. Implant Dent. 2003;12(4):325-32.
- Drosos GI, Kazakos KI, Kouzoumpasis P, Verettas DA. Safety and efficacy of commercially available demineralized bone matrix preparations: a critical review of clinical studies. Injury. 2007;28 Suppl 4:S13-21.
- Schwartz Z, Mellonig JT, Carnes DL Jr, de la Fontaine J, Cochrane DL, Dean DD, et al. Ability of commercial demineralized freeze-dried bone allograft to induce new bone formation. J Periodontol. 1996;67(9):918-26.
- Bae HW, Zhao L, Kanim LE, Delamarter RB, Dawson EG. Intervariability and intravariability of bone morphogenetic proteins in commercially available demineralized bone matrix products. Spine (Phila Pa 1976). 2006;31(12):1299-1306.
- John V, De Poi R, Blanchard S. Socket preservation as a precursor of future implant placement: review of the literature and case reports. Compend Contin Educ Dent. 2007;28(12):646-53.
- Steiner GG, Francis W, Burrell R, Kallet MP, Steiner DM, Macias R. The healing socket and socket regeneration. Compend Contin Educ Dent. 2008;29(2):114-6, 118, 120-4.
- Callan DP, Salkeld SL, Scarborough N. Histologic analysis of implant sites after grafting with demineralized bone matrix putty and sheets. Implant Dent. 2000;9(1):36-44.
