Sommaire
L'actinomycose est de plus en plus reconnue comme une cause de pathologie périapicale persistante ou récurrente associée au traitement endodontique. À la suite d'un traitement de canal classique des première et deuxième molaires inférieures gauches, une femme de 24 ans a présenté une lésion périapicale persistante liée à l'un des trajets fistuleux. La lésion a été enlevée par voie chirurgicale et un diagnostic d'actinomycose a été posé sur la base des résultats de la biopsie. Les particularités cliniques et histologiques de cette rare pathologie sont passées en revue.
Introduction
L'infection intraradiculaire persistante est considérée comme la cause la plus répandue de pathologie endodontique post-traitement1. Ces infections sont dues à des microorganismes qui survivent aux procédés antimicrobiens intracanalaires associés au traitement de canal et qui peuvent être liés à l'infection primaire ou à une surinfection2. Diverses espèces Actinomyces ont été observées en lien avec des infections intraradiculaires primaires, symptomatiques et non symptomatiques3,4. La fréquence déclarée de la découverte fortuite de colonies actinomycosiques dans du matériel chirurgical prélevé de lésions périapicales est inférieure à 5 % du nombre total de ce type de lésions5,6.
Dans le cas présenté ici, la présence d'Actinomyces a été détectée dans une lésion périapicale de longue date qui s'est développée à la suite d'un traitement de canal et qui a été traitée par inoculation chirurgicale. Deux ans plus tard, la lésion était partiellement résorbée et la patiente était asymptomatique.
Étude de cas
Une femme de 24 ans s'est présentée pour un abcès touchant les dents 36 et 37. Deux ans auparavant, la patiente avait subi un traitement de canal non chirurgical sur ces 2 dents, avec restaurations à l'amalgame (ill. 1). Depuis un an, la patiente ressentait un léger inconfort et une faible douleur. La douleur était sourde et intermittente et n'était reliée à aucun élément déclencheur particulier. La patiente avait aussi des antécédents d'infection du trajet fistuleux lié aux dents 36 et 37. Peu de temps avant la présente consultation, la patiente a ressenti une vive douleur soudaine, accompagnée d'une tuméfaction localisée du côté inférieur gauche. Son dentiste généraliste l'a alors immédiatement dirigée vers un spécialiste. Les examens clinique et radiographique ont confirmé le diagnostic d'abcès apical symptomatique (ill. 2). Un traitement d'urgence, consistant en une incision avec drainage et en la prescription d'amoxicilline (1 comprimé de 500 mg toutes les 8 heures pendant 7 jours), a été instauré. Le traitement par apicectomie et curetage de la lésion périapicale a été expliqué à la patiente, qui a donné son consentement éclairé.
Trois semaines après la résolution de l'infection aiguë, une incision intra-créviculaire a été pratiquée, de la face distale de la dent 37 à la face mésiale de la dent 34. Un lambeau mucopériosté de pleine épaisseur a été élevé par une seule incision de décharge dans la zone mésiale de la dent 34. La dégranulation de la lésion a révélé la présence de granules jaunâtres. Un échantillon de tissu a été prélevé et mis dans une solution de formaldéhyde à 10 %, puis a été envoyé au pathologiste buccal pour une biopsie. Afin de vérifier s'il y avait fracture radiculaire, du bleu de méthylène a été appliqué sur la surface radiculaire qui a ensuite été irriguée avec du sérum physiologique (chlorure de sodium à 0,9 %). L'examen du siège chirurgical n'a révélé aucun signe de fracture radiculaire. Une résection de 3 mm de la racine distobuccale et une préparation rétrograde de classe I ont été réalisées avec des embouts ultrasoniques KiS de 3 mm (Spartan, Fenton, MO). Un agrégat minéral de trioxyde gris (ProRoot MTA, Dentsply, Konstanz, Allemagne) a été utilisé comme matériau d'obturation rétrograde. La racine linguale n'a pas été réséquée à cause de sa proximité avec le canal dentaire inférieur (ill. 3). Le lambeau buccal a été repositionné et suturé aux tissus linguaux par des sutures simples à points séparés et l'incision de décharge verticale a été fermée par une suture simple à points séparés (fil Vicryl 5-0 et aiguille FS-2; Ethicon Inc., Somerville, NJ). Les sutures ont été retirées 2 semaines plus tard; la patiente était alors totalement asymptomatique et l'examen clinique n'a montré aucun signe d'infection. L'examen extrabuccal n'a révélé aucune sensibilité dans les ganglions sous-maxillaires gauches ni aucun œdème intrabuccal.
Un diagnostic d'actinomycose a été posé sur la base des résultats de l'examen histopathologique, et plus particulièrement de la présence de granules jaunes actinomycosiques caractéristiques de l'infection dans la lésion périapicale (ill. 4). Deux ans plus tard, la patiente était toujours asymptomatique et l'examen radiographique a révélé une résorption partielle de la lésion périapicale (ill. 5).
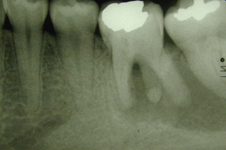 Ill. 1 : Radiographie prise avant le traitement de canal pratiqué chez la patiente, 2 ans avant la présente consultation. Une large zone radioclaire est visible dans la portion apicale des dents 36 et 37.
Ill. 1 : Radiographie prise avant le traitement de canal pratiqué chez la patiente, 2 ans avant la présente consultation. Une large zone radioclaire est visible dans la portion apicale des dents 36 et 37.
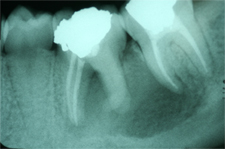 Ill. 2 : Deux ans après le traitement de canal, une radiographie rétroalvéolaire de suivi montre une large zone radioclaire périapicale, qui s'étend de la racine mésiale de la dent 36 à la racine mésiale de la dent 37.
Ill. 2 : Deux ans après le traitement de canal, une radiographie rétroalvéolaire de suivi montre une large zone radioclaire périapicale, qui s'étend de la racine mésiale de la dent 36 à la racine mésiale de la dent 37.
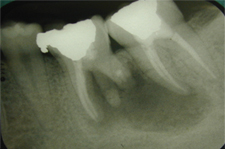 Ill. 3 : Radiographie rétroalvéolaire prise immédiatement après la chirurgie décrite dans le présent article.
Ill. 3 : Radiographie rétroalvéolaire prise immédiatement après la chirurgie décrite dans le présent article.
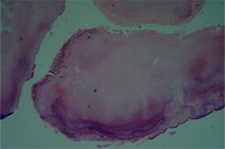 Ill. 4 : Agrégat bactérien extrait de la lésion périapicale épithélialisée, indiquant la présence d'actinomycose. L'agrégat est entouré de cellules inflammatoires. Hématoxyline-éosine; grossissement initial ×20.
Ill. 4 : Agrégat bactérien extrait de la lésion périapicale épithélialisée, indiquant la présence d'actinomycose. L'agrégat est entouré de cellules inflammatoires. Hématoxyline-éosine; grossissement initial ×20.
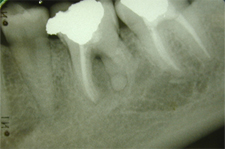 Ill. 5 : La radiographie rétroalvéolaire obtenue 2 ans après le traitement chirurgical de l'actinomycose montre une résorption partielle de la lésion.
Ill. 5 : La radiographie rétroalvéolaire obtenue 2 ans après le traitement chirurgical de l'actinomycose montre une résorption partielle de la lésion.
Discussion
L'actinomycose peut se manifester sous l'une des 3 formes suivantes : aiguë, subaiguë ou chronique. Le siège de l'infection est généralement légèrement sensible et l'infection proprement dite peut se caractériser par des fistules de drainage et un écoulement purulent. L'examen histologique montre la présence de tissu fibreux proliférant qui contient des leucocytes polynucléaires, des macrophages et des cellules géantes multinucléées qui entourent habituellement les colonies d'organismes filamenteux. Des structures en forme de massue (claviformes) sont parfois visibles en périphérie des colonies7 de dimensions très variables (de microscopiques à visibles à l'œil nu) et souvent jaunes et partiellement calcifiées8.
Bien que la présence d'espèces Actinomyces dans la cavité buccale n'ait rien d'anormal, ces espèces peuvent causer des infections endodoniques7,9. De fait, ces espèces sont sans doute parmi les premières espèces colonisatrices de la pulpe exposée, étant donné leur forte prévalence dans la dentine carieuse10. Outre leur présence fréquente dans les dents atteintes d'infections endodontiques primaires, les espèces Actinomyces ont aussi été reliées à des lésions périapicales non guéries3,11. Elles ont été observées dans des surinfections intraradiculaires persistantes et pourraient être la cause exclusive de l'infection extra-radiculaire connue sous le nom d'actinomycose périapicale. Des chercheurs ayant étudié le microbiote présent dans les canaux radiculaires obturés de dents atteintes de parodontite apicale post-traitement ont découvert la présence d'espèces Actinomyces dans 3 % à 24 % des dents12-14. De même, Borssen et Sundqvist15 ont découvert des espèces Actinomyces dans 10,6 % des 235 échantillons de canaux radiculaires dont la culture bactérienne avait été positive. Au nombre des 25 souches d'Actinomyces isolées, 17 provenaient du canal radiculaire de dents à pulpe nécrosée, 5 de dents à canaux obturés et 3 de dents à pulpe vivante. La plupart des cas d'actinomycose périapicale ont fait l'objet de rapports isolés et seules quelques études présentent des données sur la fréquence de l'actinomycose dans les lésions périapicales9,16,17. Le diagnostic repose habituellement sur l'identification des colonies actinomycosiques typiques dans un prélèvement chirurgical7.
Bien que les espèces Actinomyces aient habituellement une faible pathogénicité, ces bactéries peuvent causer une infection pyogène chronique qui peut se propager aux tissus de l'hôte lorsque les barrières muqueuses normales sont altérées par un traumatisme, une chirurgie ou une infection antérieure9. Dans certaines circonstances, l'envahissement des tissus hôtes par ces bactéries peut causer la formation d'un abcès aigu. Une co-infection par d'autres bactéries peut également influencer la pathogénicité d'Actinomyces et en accroître la virulence18.
L'actinomycose périapicale est une lésion persistante associée à une infection actinomycosique, qui serait un facteur contributif dans la persistance de radioclartés périapicales après un traitement de canal5,19. Le défaut de maintenir l'asepsie durant le traitement est l'une des principales causes de ce type de surinfections. Des surinfections peuvent également survenir après l'obturation de canaux radiculaires et constituer ainsi une cause de pathologies post-traitement1.
Un diagnostic précis d'actinomycose périapicale ne peut être posé qu'après l'ablation chirurgicale de la lésion. Une antibiothérapie prolongée à action systémique est le traitement de choix pour toutes les formes cliniques d'actinomycose20, sauf la forme périapicale. De fait, la plupart des cas signalés d'actinomycose périapicale ont été traités avec succès par chirurgie apicale ou extraction de la dent infectée7 et, dans plusieurs de ces cas, aucune antibiothérapie systémique n'a été prescrite et la guérison s'est faite sans incident19,21. Sur 16 dents avec actinomycose périapicale, Happonen21 n'a signalé qu'un seul cas confirmé d'infection persistante consécutive à une chirurgie apicale.
Bien que le mécanisme pathogène exact d'Actinomyces reste à préciser, certaines données pourraient aider à expliquer la nature des infections causées par ces microorganismes. La plupart des espèces Actinomyces sont peu virulentes et leur simple présence dans les tissus est généralement insuffisante pour causer une infection. Cependant, les tissus pulpaires nécrosés n'offrent aucune résistance contre l'envahissement par des microorganismes, à l'exception des pressions de sélection exercées par les conditions ambiantes, qui sont sans doute adéquates pour la plupart des espèces Actinomyces. De plus, certaines espèces Actinomyces ont des structures fimbriées qui pourraient jouer un rôle dans la coagrégation bactérienne à l'intérieur du canal radiculaire et pourraient donc être un facteur important dans la survie des bactéries dans la lésion périapicale. Ces fimbria permettraient aussi aux cellules d'Actinomyces d'adhérer aux parois canalaires et aux débris dentinaires expulsés par le foramen apical durant le traitement, et d'adhérer à d'autres bactéries ou cellules de l'hôte durant leur progression dans les tissus périapicaux22. D'après la littérature, y compris les études de cas précédemment publiées, les lésions périapicales contaminées par Actinomyces ont peu de chance de guérir après un traitement de canal non chirurgical isolé.
L'AUTEUR
Références
- Siqueira JF Jr. Aetiology of root canal treatment failure: why well-treated teeth can fail. Int Endod J. 2001;34(1):1-10.
- Siqueira JF Jr. Endodontic infections: concepts, paradigms, and perspectives. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2002;94(3):281-93.
- Siqueira JF Jr, Rocas IN, Souto R, de Uzeda M, Colombo AP. Actinomyces species, streptococci, and Enterococcus faecalis in primary root canal infections. J Endod. 2002;28(3):168-72.
- Xia T, Baumgartner JC. Occurrence of Actinomyces in infections of endodontic origin. J Endod. 2003;29(9):549-52.
- Sakellariou PL. Periapical actinomycosis: report of a case and review of the literature. Endod Dent Traumatol. 1996;12(3):151-4.
- Nair PN, Sjogren U, Figdor D, Sundqvist G. Persistent periapical radiolucencies of root-filled human teeth, failed endodontic treatments, and periapical scars. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 1999;87(5):617-27.
- Ricucci D, Siqueira JF Jr. Apical actinomycosis as a continuum of intraradicular and extraradicular infection: case report and critical review on its involvement with treatment failure. J Endod. 2008;34(9):1124-9. Epub 2008 Jul 24.
- Browne RM, O'Riordan BC. A colony of actinomyces-like organisms in a periapical granuloma. Br Dent J. 1966;120(12):603-6.
- Hirshberg A, Tsesis I, Metzger Z, Kaplan I. Periapical actinomycosis: a clinicopathologic study. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2003;95(5):614-20.
- Hoshino E, Ando N, Sato M, Kota K. Bacterial invasion of non-exposed dental pulp. Int Endod J. 1992;25(1):2-5.
- Nair PN. On the causes of persistent apical periodontitis: a review. Int Endod J. 2006;39(4):249-81.
- Rolph HJ, Lennon A, Riggio MP, Saunders WP, MacKenzie D, Coldero L, et al. Molecular identification of microorganisms from endodontic infections. J Clin Microbiol. 2001;39(9):3282-9.
- Molander A, Reit C, Dahlen G, Kvist T. Microbiological status of root-filled teeth with apical periodontitis. Int Endod J. 1998;31(1):1-7.
- Pinheiro ET, Gomes BP, Ferraz CC, Sousa EL, Teixeira FB, Souza-Filho FJ. Microorganisms from canals of root-filled teeth with periapical lesions. Int Endod J. 2003;36(1):1-11.
- Borssen E, Sundqvist G. Actinomyces of infected dental root canals. Oral Surg Oral Med Oral Pathol. 1981;51(6):643-8.
- Bystrom A, Happonen RP, Sjogren U, Sundqvist G. Healing of periapical lesions of pulpless teeth after endodontic treatment with controlled asepsis. Endod Dent Traumatol. 1987;3(2):58-63.
- Ramachandran Nair PN, Schroeder HE. Periapical actinomycosis. J Endod. 1984;10(12):567-70.
- Peters LB, Wesselink PR, van Winkelhoff AJ. Combinations of bacterial species in endodontic infections. Int Endod J. 2002;35(8):698-702.
- Sjogren U, Happonen RP, Kahnberg KE, Sundqvist G. Survival of Arachnia propionica in periapical tissue. Int Endod J. 1988;21(4):277-82.
- Smego RA Jr, Foglia G. Actinomycosis. Clin Infect Dis. 1998;26(6):1255-61; quiz 1262-3.
- Happonen RP. Periapical actinomycosis: a follow-up study of 16 surgically treated cases. Endod Dent Traumatol. 1986;2(5):205-9.
- Figdor D, Sjogren U, Sorlin S, Sundqvist G, Nair PN. Pathogenicity of Actinomyces israelii and Arachnia propionica: experimental infection in guinea pigs and phagocytosis and intracellular killing by human polymorphonuclear leukocytes in vitro. Oral Microbiol Immunol. 1992;7(3):129-36.
